Die Verfügbarkeit essentieller Nährstoffe ist für eine gute Pflanzengesundheit und höhere Ernteerträge von entscheidender Bedeutung.
| Essentielle Nährstoffe für Pflanzen | |
|---|---|
| Primärnährstoffe | Stickstoff |
| Phosphor | |
| Kalium | |
| Sekundäre Nährstoffe | Kalzium |
| Magnesium | |
| Schwefel | |
| Mikronährstoffe | Bor |
| Chlor | |
| Kupfer | |
| Eisen | |
| Mangan | |
| Molybdän | |
| Zink | |
Mit dem Fortschritt von Technik und Wissenschaft, Menschen haben viele Wege gefunden, den Boden mit den oben genannten essentiellen Nährstoffen im Boden zu ergänzen. Anorganische Düngemittel und Biodünger haben in der Landwirtschaft eine entscheidende Rolle gespielt.
*Muss gelesen werden : Was ist Biodünger:seine Arten und Verwendungen
| Nährstoff | Funktion | Verfügbarkeit zum Pflanzen | Symbol |
|---|---|---|---|
| Stickstoff | Fördert schnelles Wachstum Chlorophyllbildung und Proteinsynthese | Anion und Kation | NR. 3- NH4+ |
| Phosphor | Stimuliert das frühe Wurzelwachstum Beschleunigt die Reife Stimuliert die Blüte Unterstützt die Samenbildung | Anion | H2PO4- HPO4- - |
| Kalium | Erhöht die Widerstandsfähigkeit gegen Dürre und Krankheiten Erhöht die Stiel- und Strohstärke Erhöht die Qualität von Getreide und Saat | Kation | K+ |
| Kalzium | Verbessert die Wurzelbildung Steifigkeit von Stroh und Kraft Erhöht die Widerstandsfähigkeit gegen Keimlingskrankheiten | Kation | Ca++ |
| Magnesium | Unterstützt die Chlorophyllbildung und den Phosphorstoffwechsel Hilft, die Aufnahme anderer Nährstoffe zu regulieren | Kation | Mg++ |
| Schwefel | Aminosäuren Vitamine Verleiht dunkelgrüne Farbe Stimuliert die Samenproduktion | Anion | SO4- - |
| Bor | Unterstützt den Kohlenhydrattransport und die Zellteilung | Anion | H3BO3 H2BO3- HBO3- - BO3- - - B4O7- - |
| Kupfer | Enzyme Lichtreaktionen | Kation | Cu++ |
| Eisen | Chlorophyllbildung | Kation | Fe++ Fe+++ |
| Mangan | Oxidations-Reduktions-Reaktionen. Beschleunigt Keimung und Reifung | Kation | Mn++ |
| Zink | Auxine Enzyme | Kation | Zn++ |
| Molybdän | Unterstützt die Stickstofffixierung und Nitratassimilation | Anion | MoO4- - |
| Kobalt | Unverzichtbar für die Stickstofffixierung | Kation | Co++ |
| Nickel | Getreidefüllung, Lebensfähigkeit des Saatguts | Kation | Ni++ Ni+++ |
| Chlor | Wasserverbrauch | Anion | CI- |
Anorganischer Dünger ist jede Substanz synthetischen Ursprungs, die dem Boden zugesetzt wird, um Pflanzen mit Nährstoffen zu versorgen.
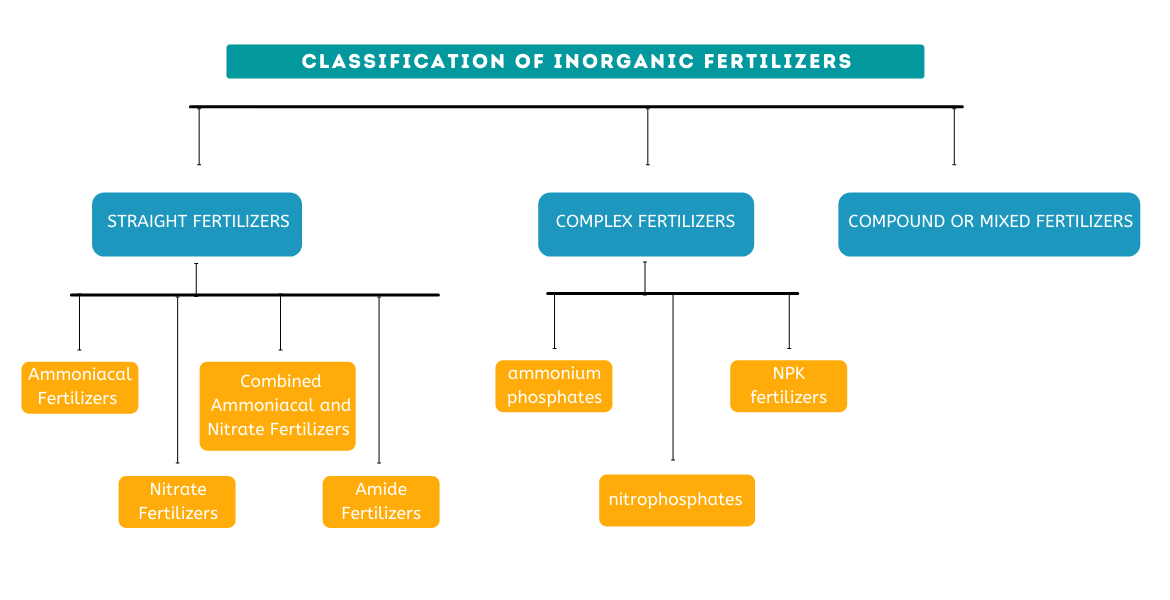
Anorganische Düngemittel lassen sich in drei Kategorien einteilen:
(ich) Einzeldünger :Düngemittel, die nur ein primäres chemisches Element liefern, werden als Einzeldünger bezeichnet.
(ii) Mehrnährstoffdünger :Mehrnährstoffdünger sind Mehrnährstoffdünger, die durch chemische Reaktionen zwischen Komponenten hergestellt werden, die die primären Pflanzennährstoffe enthalten. Die durch die chemischen Reaktionen entstehenden einzelnen Granulate enthalten alle vorgesehenen Nährstoffe.
(iii) Mehrnährstoffdünger ODER Mischdünger :Wie der Name andeutet, Mehrnährstoff- oder Mischdünger bestehen aus Granulaten oder Mischungen verschiedener Einzelnährstoffdünger. Dies sind physikalische Mischungen von Einzeldüngern. Die einzelnen Granulate haben noch immer nur einen Nährstoff.
Düngemittel können auch nach der physikalischen Form klassifiziert werden, d.h. Fest oder Flüssig .
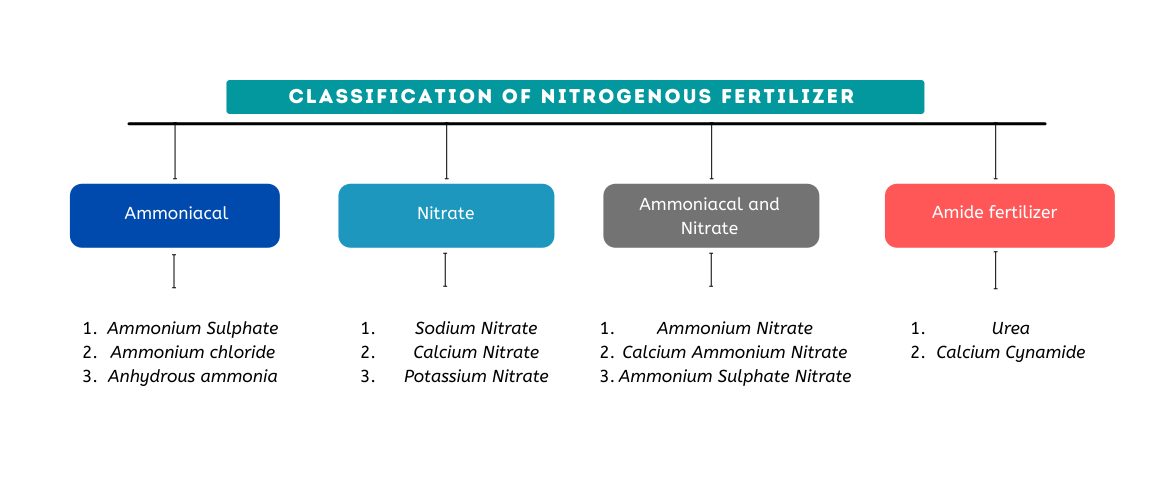
Es gibt vier Grundtypen von Stickstoffdüngern basierend auf der chemischen Form, in der der Stickstoff vorliegt:Ammoniumverbindungen, Nitratverbindungen, kombinierte Ammonium- und Nitratverbindungen, und Amidverbindungen.
Ammoniakdünger enthalten Stickstoff in Form von Ammoniumionen, NH4 + . Ammoniumionen gehen bei der Auswaschung im Boden nicht verloren, da sie von Bodenkolloiden adsorbiert werden, aber sie werden von Bakterien schnell in Nitrat umgewandelt. Pflanzen können in den frühen Wachstumsstadien einen Teil ihres Stickstoffs als Ammoniumionen aufnehmen. So liefern ammoniakalische Düngemittel entweder vor oder nach der Nitrifikation ausreichend Stickstoff.
Die kontinuierliche Anwendung von ammoniakalischen Düngemitteln kann den Säuregehalt des Bodens erhöhen. Ammoniumsulfat und Ammoniumchlorid sind Beispiele für ammoniakalische Düngemittel.
Der Stickstoff in Nitratdüngern liegt in Form des Nitrations vor, NEIN . Pflanzen nehmen in dieser Form einen Großteil ihres Stickstoffs auf. Bodenkolloide können Nitratdünger nicht zurückhalten. Als Ergebnis, Stickstoff geht durch Auswaschung verloren, wenn auf die Ausbringung von Nitratdünger starke Regenfälle oder Bewässerung folgen.
Es ist auch üblich, dass Nitrate insbesondere in wassergesättigten Böden einer Denitrifikation unterliegen. Daher werden sie im Allgemeinen nicht für Feuchtgebietsreis empfohlen. Beim Auftragen auf Erde, Nitratdünger wirken alkalisch. Beispiele umfassen Natriumnitrat und Calciumnitrat.
In diesen Düngemitteln sind sowohl Ammoniak- als auch Nitrationen enthalten. So, sie haben die Vor- und Nachteile von ammoniakalischen und nitrathaltigen Düngemitteln. Ammoniumnitrat, Ammoniumsulfatnitrat, und Calciumammoniumnitrat sind Beispiele für übliche Einzeldünger dieser Art.
Der Stickstoff in diesen einfachen organischen Verbindungen ist für Pflanzen nicht ohne weiteres verfügbar. Ein Amiddünger wird beim Ausbringen auf den Boden schnell in eine ammoniakalische Form und dann in eine Nitratform umgewandelt. Da sie wasserlöslich sind, Beim Aufbringen auf den Boden ist darauf zu achten, dass Stickstoffverluste durch Auswaschung vermieden werden. Eines der bedeutendsten Beispiele für Amiddünger ist Harnstoff.
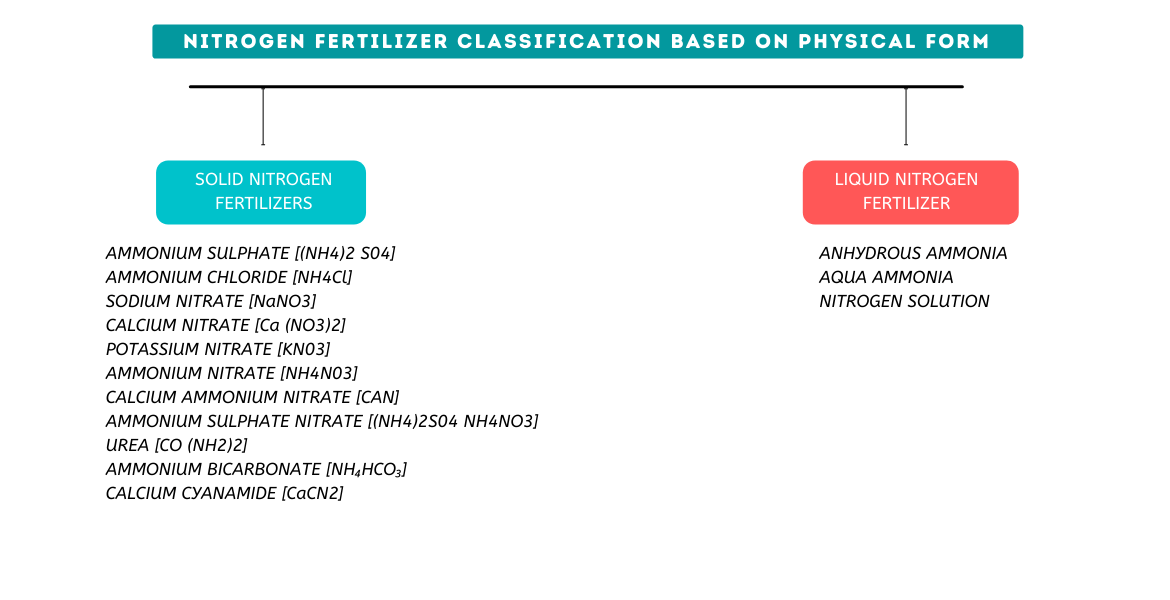
Im Folgenden sind die Beispiele für Stickstoffdünger aufgeführt, die üblicherweise in der Landwirtschaft verwendet werden
Einer der frühesten synthetischen stickstoffhaltigen Düngemittel (sieht aus wie weißes Salz) war Ammoniumsulfat (20,7 Prozent Stickstoff und 24,0 Prozent Schwefel). Jedoch, wegen seines geringen Nährstoffgehalts und relativ hohen Herstellungskosten, seine Bedeutung hat abgenommen und es wurde weitgehend durch Düngemittel mit einer höheren Stickstoffkonzentration ersetzt.
Neben der Anwendung vor der Aussaat Ammoniumsulfat kann als Top-Dressing auf den Boden aufgetragen werden, wenn eine Pflanze zu wachsen beginnt.
Sein Schwefelgehalt macht ihn zu einem besonders nützlichen Stickstoffdünger in Gebieten mit Schwefelmangel.
Eine Vermischung mit Samen sollte vermieden werden, da die Keimung beeinträchtigt werden kann.
Da die Bodenkolloide den Ammoniumstickstoff in diesem Dünger zurückhalten, und die anschließende Beständigkeit gegen Auslaugen, es ist ein ausgezeichneter Dünger für den Reisanbau in Feuchtgebieten und den Juteanbau.
Es ist leicht zu handhaben und trocken gelagert gut zu lagern. Es kann während der Regenzeit manchmal Klumpen bilden.
Eine Sulfidschädigung kann auftreten, wenn Ammoniumsulfat unter stark reduzierten Bedingungen oder auf sauren Sulfatböden verwendet wird.
Ammoniumsulfat hat eine säuernde Wirkung. Daher, seine kontinuierliche Anwendung kann den Säuregehalt des Bodens erhöhen und die Ernteerträge senken (obwohl es auf alkalischen Böden von Vorteil sein kann). Calciumcarbonat (Kalkstein) kann die säuernde Wirkung von Ammoniumsulfat ausgleichen; 110 kg Calciumcarbonat können 100 kg Ammoniumsulfat ausgleichen.
Ammoniumchlorid wird entweder durch Neutralisation von Ammoniak mit Salzsäure oder als Nebenprodukt bei der Herstellung von Soda hergestellt. Es gibt nur sehr wenige Länder, in denen diese Produkte hergestellt werden, und kleine Mengen produziert werden.
Ammoniumchlorid ist von Natur aus weiß und kristallin und enthält 25-26 % Stickstoff. Physisch, es ähnelt Ammoniumsulfat und ist wasserlöslich.
Ähnlich wie Ammoniumsulfat Ammoniumchlorid kann vor der Aussaat ausgebracht werden, und als Seiten- und Spitzendünger, wenn die Kultur wächst.
Ammoniumchlorid ist saurer als Ammoniumsulfat, erfordert 128 kg Calciumcarbonat, um 100 kg Ammoniumchlorid zu neutralisieren.
Die Zugabe von Ammoniumchlorid kann aufgrund seiner Umwandlung in lösliches Calciumchlorid, das leicht ausgewaschen wird, auch zu größeren Calciumverlusten führen.
Ammoniumchlorid wird in seiner agronomischen Eignung allgemein mit Ammoniumsulfat und anderen Stickstoffdüngern gleichgesetzt. Jedoch, Tabak, Gemüse mögen Tomate , Kartoffeln , Sellerie , Spargel , Zwiebel , Gurke , Kopfsalat , dicke Bohnen und Früchte mögen Stachelbeere , Himbeere , Erdbeere , Brombeere , Blaubeere , Mango , Avocado , Pfirsich , Granatapfel und eine Reihe anderer chloridempfindlicher Kulturen wird nicht empfohlen, mit Ammoniumchlorid behandelt zu werden.
Bei normalen Temperaturen und atmosphärischem Druck, Ammoniak (82 Prozent Stickstoff) ist ein farbloses, stechendes und giftiges Gas. Die Verflüssigung kann durch Abkühlen oder Anlegen von Druck erreicht werden, und das Gas wird bei Lagerung und Transport als Flüssigkeit gehandhabt.
Wasserfreies Ammoniak ist normalerweise nicht explosiv, aber wenn es in gewissen Verhältnissen mit Luft vermischt wird, kann es sich durch einen Funken entzünden; das Vorhandensein von Öl erhöht das Explosionsrisiko.
Wasserfreies Ammoniak kann mit Druckgeräten direkt in den Boden injiziert werden. mit einer speziellen Linie, die es aufgrund seiner flüchtigen Natur 10-20 cm unter der Oberfläche aufträgt.
Wasserfreies Ammoniak ist agronomisch genauso wirksam wie die meisten festen stickstoffhaltigen Düngemittel. Es muss, jedoch, gehandhabt werden, gelagert, mit besonderer Ausrüstung und Sorgfalt transportiert und verwendet werden.
Die in wasserfreien Ammoniakanwendungen verwendete Ausrüstung ist teuer und ziemlich kompliziert, Daher ist es nur für große landwirtschaftliche Betriebe und Lohnunternehmen geeignet.
Soda wird mit Salpetersäure behandelt, um synthetisches Natriumnitrat herzustellen.
Für saure Böden, Natriumnitrat ist besonders nützlich.
Natriumnitrat ist eine kristalline weiße Substanz, die in Wasser gut löslich ist.
Die Nitrationen werden von den Pflanzen aufgenommen, wenn Natriumnitrat auf den Boden aufgebracht wird. Natriumnitrat, das langfristig auf den Boden aufgebracht wird, beeinflusst die Bodenstruktur aufgrund der Ansammlung der ausgelassenen Natriumionen, die von den Pflanzen nicht aufgenommen werden.
Aufgrund seines geringen Nährstoffgehalts (16 Prozent Stickstoff) seine Verwendung als Stickstoffdünger ist begrenzt, und wegen der Gefahr der Nitratauswaschung, es wird vorzugsweise auf aktiv wachsende Feldfrüchte angewendet.
Chile Salt Peter oder Chilenisches Nitrat sind andere Namen für Natriumnitrat, wie es in Chile natürlich vorkommt. Chile ist einer der größten Produzenten dieses Stoffes.
Zerkleinerter Kalkstein reagiert mit Salpetersäure zu Calciumnitrat. Diese Verbindung kann auch durch einige Nitrophosphat-(Komplexdünger)-Prozesse als Nebenprodukt hergestellt werden.
Calciumnitrat hat eine körnige Form und eine fast weiße Farbe. Es ist extrem hygroskopisch, stark alkalisch reagierend, und sehr gut wasserlöslich.
Es enthält fast 15,5 Prozent Stickstoff und 19,5 Prozent Kalzium.
Es gilt als ausgezeichnete Stickstoffquelle für eine Reihe von Gemüse- und Obstkulturen, die speziell Kalzium benötigen. Außerdem, Kalzium hilft auch bei der Aufrechterhaltung des pH-Wertes des Bodens.
Wie bei Natriumnitrat, Calciumnitrat wird vorzugsweise angewendet, wenn das Pflanzenwachstum aktiv ist, um Auswaschung und Verlust zu vermeiden.
Aufgrund seiner geringen Konzentration seine Verwendung als Dünger ist begrenzt.
Gereinigtes Kaliumnitrat enthält 13,0 % Stickstoff und 36,4 % Kalium.
Kaliumnitrat ist ein starkes Oxidationsmittel. Die Farbe von Kaliumnitrat reicht von weiß bis zu schmutziggrauem kristallinem Feststoff. Es ist wasserlöslich.
Kaliumnitratdünger wird für Wachstumsbedingungen bevorzugt, bei denen ein hochlösliches, chloridfreie Nährstoffquelle benötigt wird. Der gesamte verfügbare N steht in solchen Böden sofort als Nitrat für die Pflanzenaufnahme zur Verfügung. erfordert keine weitere mikrobielle Einwirkung oder Bodenumwandlung.
Eine Kaliumnitrat-Applikation auf den Boden wird vor der Vegetationsperiode oder als Ergänzung während des Wachstums der Kultur durchgeführt.
Zusätzlich, es wird häufig verwendet für polyhouse Pflanzenproduktion und Hydrokultur.
Ammoniumnitrat ist ein weißes Pulver, Düngemittelqualitäten sind jedoch körnig oder geprillt. Diese Verbindung enthält 33-34,5 Prozent Stickstoff, ist gut wasserlöslich, und ist hygroskopisch.
Solange keine Feuchtigkeit durch Verpackung oder Lagerbedingungen aufgenommen wird, Ammoniumnitrat-Pellets sind rieselfähig und stellen kein Problem für Handhabung und Lagerung dar.
In Kombination mit brennbaren Materialien, Ammoniumnitrat kann eine Brand- und Explosionsgefahr darstellen. Es ist darauf zu achten, dass die Verhaltenskodizes für die Handhabung, Transport, und Lagerung.
Ammoniumnitrat kann vor der Aussaat der Kultur oder als Seiten- oder Deckdüngung ausgebracht werden. Ammoniumnitrat ist ideal für die meisten Pflanzen, außer Feuchtreis, da es sowohl ammoniakalischen als auch nitrathaltigen Stickstoff enthält.
Da es Stickstoff zur Hälfte in Ammonium- und zur Hälfte in Nitratform enthält, es ist, Gesamt, mittlerer Auslaugungsneigung im Vergleich zu ammoniakalischen oder nitrathaltigen Düngemitteln.
Während Böden dazu neigen, sauer zu werden, die säuernde Wirkung ist im Vergleich zu Ammoniumsulfat geringer. 59 kg Kalkstein werden benötigt, um die Wirkung von 100 kg Ammoniumnitrat auszugleichen.
Calciumammoniumnitrat (CAN) wird durch Verdünnen von Ammoniumnitrat mit einem nicht reaktiven Material gebildet, normalerweise Kalkstein, um die mit der Verwendung von Ammoniumnitrat als eigenständigen Stoff verbundenen Gefahren zu verringern.
Pulverisierter Kalkstein oder Dolomit wird mit konzentrierter Ammoniumnitratlösung granuliert, um Calciumammoniumnitrat herzustellen.
Um ein Ansammeln und Anbacken von Feuchtigkeit zu vermeiden, das Granulat ist nach dem Abkühlen mit einem inaktiven Staub überzogen. (Je nach Beschichtungsstaub) CAN-Granulat ist hellgrau bis hellbraun gefärbt und rieselfähig.
Unter feuchten tropischen Bedingungen, CAN wirft Speicherprobleme auf, Daher wird es in klimatisierten Silos gelagert.
Die Hälfte des Stickstoffs in kommerzieller KAS kommt in Form von Ammoniak und die andere Hälfte in Form von Nitrat vor. CAN enthält 25-28 Prozent Stickstoff.
Wie Ammoniumnitrat, es hat ähnliche agronomische Eigenschaften. Jedoch, CAN reagiert relativ neutral, wenn es auf Erde aufgetragen wird, im Gegensatz zu Ammoniumnitrat. es kann sogar auf sauren Böden angewendet werden.
Das Doppelsalz von Ammoniumsulfat und Ammoniumnitrat ist Ammoniumsulfatnitrat (ASN). Etwa 62,5% davon sind Ammoniumsulfat, 37,5 Prozent sind Ammoniumnitrat, und enthält 26 Prozent Stickstoff und 12,1 Prozent Schwefel.
ASN kann kristallin oder körnig sein. Kristalline Form ist weiß, die körnige Form nimmt jedoch die Farbe des aufgebrachten Schutzbeschichtungsstaubs an.
Es ist 100% wasserlöslich und hinterlässt keine Rückstände, nachdem es in Wasser gelöst wurde.
75 Prozent des Stickstoffs liegt in Form von Ammonium vor, und 25 Prozent sind in Form von Nitrat. Neben Stickstoff, es liefert auch Schwefel.
Kristallines ASN kann bei der Lagerung zusammenbacken und muss vor der Verwendung aufgebrochen werden.
Vor der Aussaat kann ein ASN-Antrag gestellt werden, während der Aussaat, oder als Seiten- oder Top-Dressing.
Eine gemischte ammoniakalische oder nitrathaltige Stickstoffquelle, es hat ein etwas geringeres Auswaschungsrisiko als Ammoniumnitrat.
Eine saure Wirkung wird durch ASN erzeugt, die zwischen Ammoniumsulfat und Ammoniumnitrat liegt – 85 kg Kalkstein werden benötigt, um die Wirkung von 100 kg ASN zu neutralisieren.
Als konzentriertester fester Stickstoffdünger Harnstoff hat spürbare Vorteile bei der Lagerung, Transport, und Handhabung. Es ist auf dem Markt weit verbreitet, und es kostet oft weniger pro Stickstoffeinheit als andere Stickstoffdünger. Daher, seine Verwendung nimmt weltweit rapide zu.
Die Körnchen oder Prills von Harnstoff sind weiß und rieselfähig. Aufgrund der hygroskopischen Natur des Harnstoffs Eine geeignete Verpackung ist erforderlich, um die Feuchtigkeitskontamination zu reduzieren. Kommerzieller Harnstoff enthält 46 Prozent Stickstoff, in Form von Amid.
Harnstoff wird in Ammoniumcarbonat umgewandelt, sobald er auf den Boden aufgebracht wird. Dies führt zu einer hohen Ammoniakkonzentration im Boden.
Das Ammoniak wird von den Kolloiden des Bodens gehalten, wenn Harnstoff mit dem Boden vermischt wird. Aber wenn Harnstoff auf der Oberfläche des Bodens aufgebracht wird, dann könnte der Großteil des Ammoniaks durch Verflüchtigung in die Atmosphäre verloren gehen. Die Menge an Ammoniak, die verloren geht, hängt von der Art des Bodens , Bodenfeuchtigkeit, Temperatur und Niederschlag.
Zusätzlich, Harnstoff schädigt junge Sämlinge. Daher sollte Harnstoff vorsichtig verwendet werden. Harnstoff ist in Wasser gut löslich. Somit, Es ist ratsam, es in Lösungsdüngern oder Blattsprays zu verwenden.
Es reagiert im Boden sauer. 80 kg Kalkstein können die saure Wirkung von 100 kg Harnstoff ausgleichen.
Biuret, eine giftige Verunreinigung, wird manchmal in Harnstoff gefunden. Da Harnstoff auf über 140°-170°C erhitzt wird, zwei Moleküle Harnstoff werden Biuret, wenn das NH3 eluiert wird. Wenn Wasser oder Ammoniak vorhanden ist, mehr Biuret wird gebildet. Biuret-Toxizität wurde für mehrere Kulturpflanzen berichtet. Es hat sich gezeigt, dass biuretreicher Harnstoff die Keimung und das Wachstum von Weizen- und Maissamen beeinträchtigt.
Wenn Harnstoff ist angewendet in einer band in der Nähe des Samens, die Keimung von Weizen- und Gerstensamen wird beeinträchtigt, selbst wenn der Biuret-Gehalt im Harnstoff 1-2% beträgt. Jedoch, im Broadcast-Verfahren der Bewerbung, Harnstoff mit sogar 10 % Biuret hat keine negativen Auswirkungen. Wenn Harnstoff wird gesprüht , der Biuret-Gehalt sollte 1 % nicht überschreiten.
Der Biuret-Gehalt im Harnstoff führt zu einer Gelbfärbung der Blätter und einem schalenförmigen Wachstum bei Zitrusfrüchten, Kaffee und Ananas . Biuret beeinflusst auch den Stoffwechsel von Proteinen und verursacht Proteolyse. Es wurde beobachtet, dass Pflanzen seit Monaten Biuret enthalten. Deswegen, kommerzieller Harnstoff wird geprüft und qualitätskontrolliert, damit der Biuret-Gehalt unter den Gefahrenstufen gehalten werden kann.
Harnstoff ist für die meisten Kulturen geeignet und kann verwendet werden auf alle Arten von Böden und kann bei der Aussaat oder als Top-Dressing angewendet werden.
Einige asiatische Länder, insbesondere China, Verwenden Sie in begrenztem Umfang Ammoniumbicarbonat.
Der Stickstoffgehalt von Ammoniumbikarbonarte-Dünger beträgt 17 Prozent.
Es kann aufgrund seiner Instabilität einen Teil seines Ammoniaks an die Atmosphäre abgeben, bevor es vom Boden aufgenommen werden kann. insbesondere bei Anwendung als Top-Dressing auf kalkhaltigen oder alkalischen Böden.
Dies ist ein Calciumsalz des Cyanamids (CN
2−
2 . ) Anion. Calciumcyanamid wird auch als Nitrokalk bezeichnet. Es enthält 21 Prozent Stickstoff.
Es ist eine grau-weiße pulvrige Substanz, die sich in feuchtem Boden zersetzt, Ammoniak produzieren.
Neben der Wirkung als Stickstoffdünger, es tötet auch Insekten, Bodenparasiten, und schädliche Pilze, und wirkt daher auch als wirksames Pestizid und Fungizid.
Ebenfalls, Calciumcyanamid wirkt als Entlaubungsmittel und Herbizid, indem es die Keimung von Unkraut verhindert.
In den meisten Fällen, Aqua-Ammoniak (in Wasser gelöster Ammoniak) enthält 20 Prozent Stickstoff, obwohl es in einigen handelsüblichen Qualitäten bis zu 26 Prozent Stickstoff enthalten kann.
Aqua Ammoniak bietet viele Vorteile gegenüber wasserfreiem Ammoniak, einschließlich seiner einfacheren Handhabungsanforderungen und seiner drucklosen Natur, wodurch die meisten Gefahren beseitigt werden.
Die Speicherung von Aqua-Ammoniak kann mit gewöhnlichen Lagertanks erreicht werden, im Gegensatz zu Edelstahl-Lagertanks im Fall von wasserfreiem Ammoniak, was teuer werden kann.
Aqua-Ammoniak muss auch tief in den Boden eingebracht werden, um Stickstoffverlust zu vermeiden.
Es gibt zwei Arten von Stickstofflösungen:drucklose und Niederdruck.
In der Regel, drucklose Lösungen werden aus Harnstoff und Ammoniumnitrat hergestellt und enthalten bis zu 28-32 Prozent Stickstoff. Drucklösungen werden hergestellt, indem Ammoniak mit Ammoniumnitrat oder Harnstoff oder beidem kombiniert wird. und kann bis zu 41 Prozent Stickstoff enthalten.
Sein Vorteil ist, dass es einen höheren Nährstoffgehalt hat als drucklose Lösungen, aber es ist teuer wegen der Notwendigkeit der Druckbeaufschlagung, Verteilungs- und Anwendungsausrüstung.
Phosphor ist ein wichtiger Bestandteil der Erdkruste, wurde aber im Laufe der geologischen Zeit in Ablagerungen von Phosphatgestein konzentriert (hauptsächlich aus Überresten von Wasserorganismen gebildet). Es ist in den meisten natürlichen und kultivierten Böden in unzureichenden Mengen für ein volles Pflanzenwachstum vorhanden.
Damit der Dünger Phosphor den Pflanzen zur Verfügung steht, es muss in ionischer Form an die Bodenlösung abgegeben werden. Pflanzen nehmen Phosphor aus der Bodenlösung als Phosphationen (HPO4 und H2PO4) auf. Düngemittel enthalten Phosphor in einer Vielzahl von chemischen und physikalischen Formen, deren Verfügbarkeit stark schwankt.
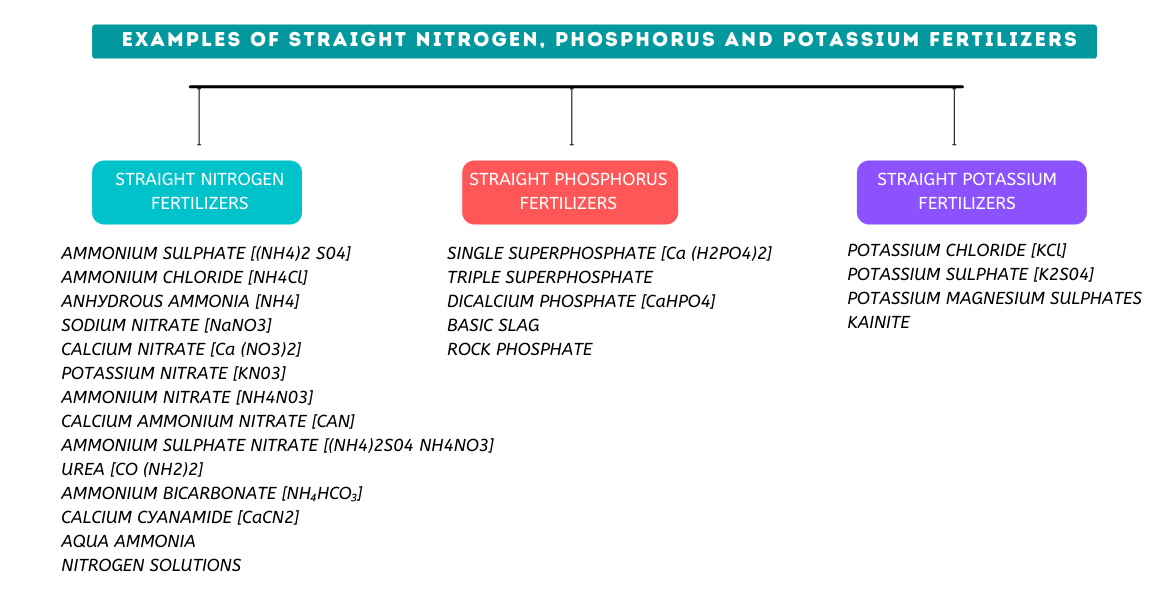
Einfaches Superphosphat, konzentriertes Superphosphat, Schlacke und Rohphosphat sind einige der typischerweise verwendeten Phosphoreinzeldünger. Nachfolgend finden Sie eine kurze Beschreibung dieser Düngemittel.
Der erste chemisch hergestellte Phosphordünger war einfaches (normales) Superphosphat (SSP). Obwohl es in vielen Ländern immer noch verwendet wird, es wurde und wird durch konzentriertere Phosphordünger und durch Mehrnährstoffdünger ersetzt.
Es wird in einem speziell entwickelten Reaktionsgefäß hergestellt, fein gemahlenes Rohphosphat wird mit konzentrierter Schwefelsäure vermischt. Mehrnährstoffdünger werden durch Trocknen und Granulieren des Produkts hergestellt, manchmal mit Stickstoff- und Kaliumdünger.
SSP ist grau oder braun, typischerweise körnig für einfache Lagerung und Anwendung. Das pulverförmige Produkt verklumpt bei der Lagerung. Im Feld, SSP granuliert lässt sich problemlos und gleichmäßig auftragen.
In SSP sind nahezu gleiche Mengen an Monocalciumphosphat und Calciumsulfat (Gips) vorhanden. Es enthält normalerweise 17-20 Prozent insgesamt P205 , davon über 90 Prozent wasserlöslich; es enthält auch etwa 16 Prozent Schwefel.
Dieses SSP enthält eine geringe Menge an freier Säure, Verpackungen sollten also einen Säureangriff verhindern können. Gutes Verpackungsmaterial können Polyethylen oder mit Polyethylen ausgekleidete Säcke sein.
SSP ist ein geeigneter Phosphordünger für die meisten Kulturen und Böden , mit Ausnahme von stark sauren Böden, wo wasserunlösliche Phosphatquellen, wie Rohphosphat, sind besser geeignet.
Ein Boden, dem es an Kalzium und Schwefel mangelt, profitiert von dem Kalzium und Schwefel, das SSP enthält.
Wenn der Dünger in Streifen nahe der Saatreihe ausgebracht wird, das in SSP enthaltene wasserlösliche Phosphat wird langsamer im Boden immobilisiert. Dadurch wird der Boden-Dünger-Kontakt minimiert.
TSP (Triple Superphosphate) wird durch Reaktion von fein gemahlenem Phosphatgestein mit konzentrierter Phosphorsäure (52 bis 54 Prozent P2O5) hergestellt. Das Granulat wird in der Regel als alleiniger Dünger oder als Bestandteil von Mehrnährstoffdüngern granuliert.
TSP enthält P2O5 im Bereich von 44 bis 52 Prozent, und ist fast vollständig wasserlöslich.
Pulverisiertes TSP neigt zum Zusammenbacken, aber granuliertes TSP hat ausgezeichnete Lager- und Handhabungseigenschaften und ist rieselfähig. Da TSP freie Phosphorsäure enthalten kann, eine geeignete Verpackung ist erforderlich.
Als Phosphordünger, TSP und SSP dienen ähnlichen Zwecken, mit dem Unterschied, dass TSP eine viel höhere Konzentration an Nährstoffen und viel weniger Schwefel hat. Da es viele Nährstoffe enthält, es ist besonders nützlich für die Herstellung von hochwertigen Mehrnährstoffdüngern.
Als Dünger, reines Dicalciumphosphat wird wegen der hohen Herstellungskosten und der unbequemen Handhabung und Anwendung seiner Pulverform selten verwendet. Es wird durch Reaktion von Rohphosphat mit Salzsäure und Zugabe von Kalk hergestellt, um einen Niederschlag zu erzeugen.
Das Handelsprodukt enthält etwa 35 Prozent P205, eine citratlösliche, aber wasserunlösliche Verbindung. Dicalciumphosphat ist auch ein citratlöslicher Bestandteil von Nitrophosphaten und anderen Mehrnährstoffdüngern.
Da das citratlösliche Phosphat von Dicalciumphosphat nicht so schnell im Boden immobilisiert wird wie Monocalciumphosphat, es gilt als wirksame Dünger-Phosphorquelle für Langzeitkulturen wie Zuckerrohr oder Kulturen mit sauren Böden.
Basische Schlacke ist ein Nebenprodukt der Stahlindustrie. Jedoch, Die Menge an phosphatreicher Schlacke ist zurückgegangen, da die Stahlindustrie moderne Technologien und auch Erze zur Stahlherstellung einsetzt.
Bei der Herstellung von Stahl, Nichteisenelemente, einschließlich Phosphor, aus dem Erz werden als Schlacke zusammen mit den bei der Herstellung zugesetzten Kalkresten vom Erz getrennt.
Die Schlacke kann bis zu 18 Prozent P205 enthalten, und es hat auch einen beträchtlichen Kalkwert.
Basische Schlacke enthält wasserunlösliches, aber in Zitronensäure lösliches Phosphat in Form von Calciumsilicophosphaten; es ist instabil und wird langsam verfügbar, besonders in sauren Böden. Schlacke eignet sich daher am besten für Langzeitkulturen, besonders auf sauren Böden; es kann auch neutralen und leicht sauren Böden Phosphor liefern.
Für eine optimale Phosphorabgabe an die Bodenlösung, basische Schlacke muss fein gemahlen werden.
Grundschlacke ist nicht hygroskopisch und gut lagerfähig, aber Puderauftrag kann sehr staubig sein; es kann auch schwierig sein, eine gleichmäßige Anwendung zu erreichen.
Um den Bodenkontakt und die Auflösung zu erhöhen, Rohphosphat wird zur direkten Anwendung fein gemahlen. Typischerweise Es wird empfohlen, die Mahlfeinheit so zu gestalten, dass 90 % des Rohphosphats durch ein 100-mesh-Sieb passieren.
Die Eignung von Rohphosphat zur direkten Anwendung variiert von Quelle zu Quelle, wobei diejenigen aus Tunesien und Marokko die besten sind.
Fein gemahlenes Rohphosphat hat eine hellgraue oder braune Farbe und einen neutralen Charakter. Der Phosphorgehalt von Rohphosphat liegt im Bereich von 29 bis 37 Prozent P2O5.
Rohphosphat ist ein langsam wirkender Phosphordünger.
Der Kalziumgehalt von Rohphosphat reicht von 35 bis 38 Prozent, jedoch, es gibt keinen kalkwert dafür.
Phosphor in gemahlenem Rohphosphat wird im Allgemeinen am besten in Böden mit einem pH-Wert unter 5,5 oder in Böden mit hohem Gehalt an organischer Substanz verwertet. Auf neutralen oder alkalischen Böden, Phosphor aus Rohphosphat ist für Pflanzen fast nicht verfügbar.
Die Kapazität von Pflanzen, Rohphosphat für Phosphor zu verwenden, variiert je nach Bodentyp, auf dem sie angebaut werden. Rüben , süßer Klee, Senf, Tee, Gummi, und Kaffee sind die effizientesten Nutzer von Rohphosphat, während Baumwolle, Reis, Weizen, gerade noch, und Kartoffeln sind am wenigsten effizient.
Es ist wichtig, den Kontakt mit dem Boden zu maximieren, also sollten Rohphosphate ausgestrahlt werden, nicht platziert. Die Gabe von Rohphosphat vor der Aussaat der Saat lässt auch etwas Zeit für die Solubilisierung.
Kalium (K) ist ein essentieller Nährstoff für das Pflanzenwachstum. Der Kaliumgehalt von Düngemitteln wird üblicherweise in Form von Kaliumoxid (K2O) oder „Kali“ angegeben.
Kaliumdünger werden aus natürlichen Vorkommen mit Kaliumsalzen in verschiedenen Ländern abgebaut und gereinigt. einschließlich Cavada, Die Vereinigten Staaten, die ehemalige Sowjetunion, Frankreich, Deutschland, und Spanien. Einige der wichtigsten Kaliummineralien sind Sylvinit (eine Mischung aus Sylvit (KCl) und Halit (NaCl)), Carnallit (KC1.MgCl2::6H2O), Kainit (KCl.MgSO4.3H2O), Langbeinit (K2SO4.2MgSO4, ) und Salpeter (KNO3).
Gängige Kaliumdünger sind Kaliumchlorid (Kalisäure), Kaliumsulfat (Kalisulfat), und Kaliummagnesiumsulfat.
Kaliumchlorid enthält etwa 60 % Kali (K2O).
Kaliumchlorid ist ein kristallines weißes Salz, Die Farbe von Kaliumchlorid in Düngemittelqualität reicht jedoch von weiß bis rot, abhängig von der Menge an Verunreinigungen in den Kalimineralien. Die Farbe hat keinen Einfluss auf die Düngewirkung.
Das auskristallisierte Kaliumchlorid ist rieselfähig und bereitet keine Probleme bei der Handhabung und Lagerung. Formal, der Dünger, der zum Zusammenbacken verwendet wird, Dieses Problem kann jedoch durch Mischen von Antibackmitteln beseitigt werden.
Das Kaliumchloridsalz ist in Wasser zu 100 % löslich. Beim Auftragen auf Erde, das Kaliumion wird von Bodenkolloiden adsorbiert und zurückgehalten, Es besteht also nur eine geringe Möglichkeit der Auslaugung. Pflanzenwurzeln nehmen die ionische Form des Nährstoffs auf.
Kaliumchlorid ist von Natur aus neutral und erzeugt keine Säure oder Alkalinität im Boden.
Der Chlorgehalt von Kaliumchlorid beträgt etwa 47 Prozent.
Obwohl Kaliumchlorid für die meisten Kulturen und Böden geeignet ist, Kaliumsulfat wird für Nutzpflanzen wie Tabak und Kartoffeln bevorzugt, wo überschüssiges Chlorid die Qualität beeinträchtigt.
Allgemein, der gesamte Kaliumbedarf kann als Grunddosis appliziert werden, aber auf sandigen Böden Gebiete mit hohem Niederschlag, und Feuchtreis, eine geteilte Anwendung wird bevorzugt.
Der häufigste Kaliumdünger ist Kaliumchlorid, Kaliumsulfat wird jedoch in geringerem Maße für bestimmte Kulturen verwendet.
In der Natur, Kaliumsulfat kommt als Langbeinit vor, ein Doppelsalz mit Magnesium (K2SO4.2MgSO4), es kann aber auch durch Einwirkung von Schwefelsäure auf Kaliumchlorid hergestellt werden.
Weißes kristallines Salz, Kaliumsulfat ist rieselfähig und enthält 48 bis 52 Prozent Kali (K2O) und 18 Prozent Schwefel. Normalerweise, Die Handhabung und Lagerung von kristallinem Kaliumsulfat ist unproblematisch.
Kaliumsulfat ist wasserlöslich, und beim Auftragen auf den Boden, die Kaliumionen werden von Bodenkolloiden zurückgehalten und werden nicht leicht ausgewaschen.
Es ist ein ausgezeichneter Dünger, der auf alle angewendet werden kann Bodenarten und Getreide. Jedoch, da es teurer ist, es wird normalerweise nur beim Anbau chloridempfindlicher Pflanzen verwendet.
Potassium sulphate is soluble in water, and when applied to the soil, the potassium ions are retained by soil colloids and do not easily leach out. It is an excellent fertilizer that can be applied to all soil types and crops.
Due to its sulphur content, it is a two-nutrient fertilizer. It can be used for tobacco, potatoes, fruits and vegetables.
Zusätzlich, it may be a good choice for saline soils as well as in Polyhaus where chloride accumulation can be a problem.
There are several fertilizers that contain both potassium and magnesium in the sulphate form, such as the above-mentioned langbeinite or schoenite (K2S04.MgSO4.6H20).
Potassium magnesium sulphate is commercially produced in Europe and the United States.
Potassium magnesium sulphate has 22-30 per cent K2O, 10-19 per cent MgO, 16-23 per cent Sulphur.
The use of potassium magnesium sulphate is especially recommended for acidic soils and soils deficient in magnesium. Zusätzlich, it is recommended for crops with high magnesium requirements, such as potatoes, fruits, Gemüse, and forest trees.
Kainite is a naturally occurring mineral.
Pure kainite has the chemical composition kcl.MgSO4.3H2O, but in nature, it rarely occurs as such.
Kainite, a commercially available product, is largely composed of potassium chloride, magnesium sulphate, and magnesium and sodium chlorides.
Kainite contains 14-22 percent K2O.
It is alkaline in nature and contains 46 per cent chlorine.
Unlike most other potassic fertilizers, it may cake in storage and need to be broken up before use.
It can be beneficial for crops that use sodium, such as sugarbeet.
As a result of the high nutrient content of complex fertilizers, the cost of packing, handling, and transport per unit of nutrient is lower than that of many straight fertilizers.
Complex fertilizers are available in granular form and are free-flowing, making them easy to handle and apply.
Complex fertilizers have the advantage of ensuring balanced fertilization of crops, especially in developing countries. The production and use of complex fertilizers is therefore on the rise and accounts for a considerable proportion of world fertilizer consumption.
Complex fertilizers can broadly be classified into (ICH) ammonium phosphates, (II) nitrophosphates and (III) NPK fertilizers.

Im Allgemeinen, ammonium phosphates are satisfactory for all crops and soils. It exhibits the characteristics of nitrogen fertilizers containing ammonium as well as highly water-soluble phosphate.
It is possible that, in some circumstances, nitrogen from urea ammonium phosphate will be less effective.
Crops are not immediately able to utilize the polyphosphate in ammonium polyphosphates, jedoch, it is quickly transformed to the available orthophosphate form in soil.
Due to its high phosphorus content, DAP is used more extensively and in crops where the phosphate requirement is relatively high; auf der anderen Seite, MAP is usually mixed with additional nitrogen and potassium intermediates due to its wide N:P205 ratio.
Monoammonium phosphate (MAP) is a high-analysis fertilizer that is almost completely soluble in water. It contains 52 to 55 per cent P2O5 and 11 to 12 per cent nitrogen.
Because it is non-hygroscopic and compatible with most other fertilizer materials, it is widely used in the manufacture of multi-nutrient fertilizers. Produced by reacting ammonia with wet phosphoric acid at a concentration of 45-52%, maintaining an NH3:H3PO4 ratio of 1:1.
Spray-drying of the concentrated MAP solution yields powdered material which is later granulated for application in the fields.
DAP (diammonium phosphate) is produced in large quantities. Commercial DAP is mostly water-soluble, free flowing and granular and contains 18 per cent nitrogen and 46 per cent P2O5.
The manufacturing process of diammonium phosphate requires a mole ratio of 2:1 between NH3 and H3PO4, which involves an additional step of ammoniation.
The slurry thus produced is granulated, dried, screened, cooled and conditioned by a coating agent.
Approximately 60% of ammonium phosphate sulphate is ammonium phosphate, while 40% is ammonium sulphate. It contains 16 percent nitrogen and about 20% P2O5.
Nitrogen content can be increased by adding urea, and a variety of N:P2O5 analysis products can be obtained.
Ammonium phosphate sulphate is a free-flowing substance that is usually not difficult to handle and store.
The chemical reaction between ammonia and phosphoric acid produces urea ammonium phosphate (UAP).
In the granulator, additional ammonia and urea are added to the ammonium phosphate slurry. A coating agent is applied to prevent caking after the material has been dried, screened and cooled.
There are various N:P2O5 analyses available. Ebenfalls, it is possible to produce liquid (solution) UAP directly, thereby avoiding drying costs.
Almost all the phosphorus is water-soluble, while some nitrogen is in the form of ammoniacal and some in the form of urea.
Free-flowing granules and good physical properties make the fertilizer an excellent choice for soil, although it may cake when humid.
By reacting ammonia with superphosphoric acid, ammonium polyphosphates (APP) are produced. Both liquids and solids are made of them.
The typical APP solutions in the USA have analyses of 11-33-0, 10-34-0, 12-40-0, and 8-27-0; jedoch, granular products can be produced with nutrient contents of up to 15-61-0, depending on the acid purity used. APP is completely soluble in water.
In APP, nitrogen is entirely in the form of ammoniacal nitrogen, and phosphate is present as monoammonium phosphate (NH4H2PO4) and orthoammonium polyphosphates.
In addition to their high analysis, APP solutions allow for the addition of large quantities of micronutrients without precipitation. Ammonium polyphosphates are mainly manufactured and used in the United States.
Nitrophosphates are fertilizers made by nitrifying phosphate rock with nitric acid or a mixture of nitric and sulphuric acids, followed by ammoniating the resulting slurry. Danach, the slurry is granulated or prilled. Additional nitrogen can then be added, in the form of ammonium nitrate, along with potassium chloride or sulphate, to achieve the desired NPK analysis.
Granulation characteristics of nitrogen phosphates are good, and they are coated to minimize moisture absorption. When properly packaged and stored, cakes do not form.
Solubility of the phosphate determines the agronomic performance of nitrophosphates. Most phosphate is citrate-soluble, jedoch, its solubility in water varies (0-80%) based on the ammoniation process.
Im Allgemeinen, all crops and soils are suitable for nitrophosphates containing 60 per cent or more water-soluble phosphate. Jedoch, low water-solubility phosphates are suitable only for long duration crops such as sugarcane or grassland, and for acid soils.
Short duration crops like cereals and potatoes are less suitable for Nitrophosphates.
Nitrogen, phosphorus, and potassium are contained in varying proportions in solid NPK fertilizers. Allgemein, they are easy to handle and apply, free flowing and granular in structure. Various grades are produced and marketed depending on soil and crop needs.
They can be prepared either by the ammonium phosphate or nitrophosphate routes by adding potassium. The production process used determines the ratio of ammonium, nitrate and urea nitrogen. The production process also determines the the content of water-soluble and citrate-soluble phosphorus.
The best way to apply them is as a basal dressing. In spite of the extensively wide range of available NPK analyses, most factories limit their output to a few products for operational reasons.
The main benefit of NPK complex fertilizers is their ease of use, including ease of handling and application of all three nutrients in just one operation. Zusätzlich, they can include calcium, Magnesium, phosphorus, and micronutrients.
There may, jedoch, be some situations where the farmer might need to apply additional amounts of these nutrients separately, as the available grades of NPK might not always meet those requirements.
Compound fertilizers, also known as mixed fertilizers, differ from complex fertilizers primarily in their method of preparation.
(i) single nutrient or two-nutrient intermediates granulated together
(ii) Using straight fertilizers or intermediates mixed together to form a blend, each granule maintaining its original composition
(iii) A mixture of powders
Compound fertilizers perform essentially the same as their components.
The physical characteristics, storage, handling, and application characteristics of granular compound fertilizers are influenced by the manufacturing process. Nichtsdestotrotz, compound fertilizers are generally safe to use as long as the coating, packaging, and storage conditions are good.
It’s also critical that the components of granular mixtures are homogenous in size and shape to avoid segregation.
Compared to granulated fertilizers, powdered fertilizers have poor storage properties and are difficult to apply uniformly. Distributors are limited in their ability to apply them.
Compound fertilizers are usually produced in factories using straight nitrate, phosphorus and potassium fertilizers, sometimes using two-nutrient intermediate fertilizers such as MAP.
The intermediates are usually in powder form or are slurries that are fed into a granulating plant, typically a large rotating drum.
Water or steam is added as needed, and rotation causes the formation of granules which are dried, screened for size, and bagged or bulk stored. The composition of granular compound fertilizers depends mainly on their agronomic suitability and availability. Using urea and superphosphate together can cause the phosphorus to lose water solubility and hence it is not preferred to mix such substances to make compound fertilizers.
Multinutrient fertilizers are made by mixing powdered (or crystalline) straight fertilizers together on the farm, thereby reducing the number of fertilizer applications needed per field.
It is possible to formulate powder mixtures with a wide range of nutrient ratios by combining and adjusting ingredients. Zum Beispiel, an 8-8-8 fertilizer can be prepared by mixing Ammonium sulphate, 20.6% N + SSP, 16.5% P205 + Potassium chloride, 60% K2O ( 39% + 48% + 14% =100%) .
Compared to granular compound fertilizers, powder compound fertilizers are more affordable. Jedoch, it has some disadvantages such as:it has short term storage capabilities, the application is more time consuming and less uniform and some of the more concentrated intermediates such as ammonium nitrate and urea cannot easily be used.
By mixing or blending granular intermediates such as CAN, MAP, and potassium chloride, the cost of re-granulation can be avoided. Bulk blending involves blending granular intermediates with compatible properties. The compatible properties such as granule size, surface properties, and density should match so that there is no segregation during storage, handling and application.
Bulk blending eliminates bagging costs, and since bulk-blended fertilizer is prepared and sold immediately before application, storage factors are no longer relevant.
The bulk blending of fertilizer is primarily developed in the United States. It is typically applied by the suppliers on contract basis, daher, the farmer’s operations are simplified as large capacity equipment belonging to the contractor can be used for application.
There are two types of liquid mixed fertilizers:clear liquids and suspension fertilizers.
Clear liquids are solutions in water that contain primary nutrients and are designed to not precipitate or salt out at prevailing temperatures since such deposits are hard to remove.
Ammonium nitrate, urea, ammonium phosphate or phosphoric acid, and potassium chloride are the most common nutrient sources. Concentrations achievable are considerably lower than with solid fertilizers, for example about 9-9-9 compared with 17-17-17.
Suspension fertilizers contain a small quantity of special clay, which delays the settling from the suspension of any salts that crystallize out. Daher, it is possible to achieve a higher level of concentration than clear liquids, but not as high as solids, and even high-quality ingredients are not required. Jedoch, suspension fertilizers require continuous agitation in storage and specialized application equipment.
Over solid fertilizers, fluid mix fertilizers have several advantages, namely reduced labor requirements, contract application options, and the ability to combine herbicides with fertilizers.
The secondary major nutrients are calcium (Ca), sulphur(S) and magnesium(Mg). Although the uptake of calcium, sulphur, and magnesium by plants is quite substantial, it is rarely as large as those of nitrogen, phosphorus, and potassium.

In soils, plants, and liming materials, calcium content may be expressed as calcium oxide (CaO) or as elemental calcium, with a factor of 0.72 between the two.
Total calcium content in soils varies greatly depending on the parent material and can be substantial in soils formed from limestones, igneous rocks such as granites, syenites, diorites, gneisses and schists.
In contrast to this, soils derived from sandstones and shales that are noncalcareous in humid areas may contain little calcium.
A liberal application of sodium nitrate over time or repeated applications of irrigation water with a high sodium chloride content may produce an alkaline soil in which sodium is the dominant cation instead of calcium.
Regardless of the total amount of calcium in the soil, the calcium present in the soil’s base exchange complex provides readily available calcium to plants. The lower the pH value (i.e. the higher the acidity) and the lower the exchange capacity value, the less calcium is exchangeable. Calcium deficiency is particularly harmful to fruits and vegetables.
It is almost completely water soluble and contains 15% calcium. Because of its highly water soluble nature, it is a good candidate for foliar nutrient application.
Calcium nitrate, also knon as Norgessalpeter , is also a highly water soluble calcium ferltilizer. It contains 26.5% calcium in the form of calcium oxide and 15.5% Nitrogen.
The magnesium content in soil, plants, or materials containing magnesium is usually expressed either as magnesium oxide (MgO) or as elemental magnesium, with a conversion factor of 0.61.
The soil magnesium content ranges from a trace to as much as 1 per cent. Magnesium is well supplied to arid areas or soils with high clay content, while sandy soils in high rainfall areas tend to have a low magnesium content because leaching removes it. Excessive potassium application can worsen magnesium deficiency. The soil exchange complex normally provides magnesium to the crop.
As compared with potassium and calcium, magnesium uptake by crops is much lower. Up until the last two decades, magnesium deficiency was rare, but now it is readily apparent in many crops, particularly potatoes, sugarbeets, brassicas, and maize.
It is best to correct magnesium deficiencies before plant establishment, using a variety of soil application treatments such as dolomitic limestone, kieserite, and various potassium magnesium fertilizers. Magnesium-containing NPK fertilizers are also available.
Considering economic factors and whether liming is needed determines the choice of magnesium fertilizer. Magnesium deficiency being observed during crop growth may be alleviated with foliar sprays of magnesium sulfate (Epsom salts) .
This magnesium fertilizer contains 5-20% magnesium in the form of MgO (magnesium oxide). It also contains 20-45% calcium oxide (CaO)
This contains 16% MgO and 13% Sulphur
This contains 7% MgO and 20% Nitrogen and 15% Sulphur
This contains 9-33% MgO and 26-58% calcium oxide (CaO)
This contains 10-18% MgO, 22-30% potassium oxide (K2O) and 16-22% sulphur(S)
This contains 20% MgO
This contains 27% MgO and 22% sulphur
This contains 33% MgO and 26.5% sulphur
This contains 45% MgO
Sulphur is a highly mobilized element in soils. When soil biomass breaks down, it is mineralized into the sulfate form that crops can absorb. It is very easy for sulphate to leach from soil. Sulfur is dissolved in rainfall and deposited in soil by dry deposition but amounts vary depending on rainfall and fossil-fuel burning.
Precipitation amounts range from a few kilograms per hectare per year to over 100 kilograms. Sulphur deficiency may occur at the lower end of this spectrum.
Among brassica crops and legumes, sulphur uptake can reach 40-60 kg/ha. There is a prevalence of sulphur deficiency among these crops on every continent.
The following methods can be used to correct sulphur deficiency:
Micronutrients, such as iron, zinc, Kupfer, manganese, boron, molybdenum, and chlorine, are used by plants in very small amounts, usually in terms of grams per hectare. Jedoch, even a few grams can mean the difference between high yields and crop failure.
Some elements are beneficial but not essential for crop growth, including cobalt, selenium, vanadium, nickel, lithium, silicon, and aluminum. These elements are not mentioned here.
Plants with micronutrient deficiencies display characteristic symptoms, but corrective measures may be too late once the symptoms appear, since the damage has already been done. When micronutrients are applied at this stage, they may not fully compensate for earlier deficiencies, resulting in a lower yield.
In order to ensure proper growth and development of the crop, it is necessary to determine whether the soil which the crop will be grown on contains sufficient micronutrients or if it is deficient in one or more micronutrients, and then to take corrective measures accordingly. Micronutrients should not be recommended as a blanket treatment in all soils and cropping situations; such an approach might actually cause more harm than good because of toxicity.
The amount or level of nutrients required for optimum growth of the plant is called the critical level . Different soils, different species, and even different varieties will have different critical levels of nutrition requirement.
| Micronutrient | Form and amount required / Ha | Spray Application Proportion |
|---|---|---|
| Eisen | Ferrous sulphate (FeSO4 7H2O), 10 kg/ha | 0.4 percent ferrous sulphate + 0.2 percent lime |
| Zink | Zinc sulphate (ZnSO4 7H2O) , zinc oxide (ZnO) , 10-50 kg/ha | 0.5 percent zinc sulphate + 0.25 percent lime |
| Manganese | Manganese sulphate ( MnSO4 7H2O) , 10-50 kg/ha | 0.6 percent manganese sulphate + 0.25 percent lime |
| Kupfer | Copper sulphate (CuSO4), 10-50 kg/ha | 0.1 percent copper sulphate + 0.05 percent lime |
| Boron | Borax (Na2B4O 10H2O), 5-20 kg/ha | 0.2 percent borax |
| Molybdän | Sodium molybdate (Na2MoO42H2O) , 0.1-0.5 kg/ha | 0.1-0.2 percent solution of ammonium molybdate |