Fischsaatgut ist die wichtigste Komponente für die Fischkultur. Die Süßwasserressourcen unseres Landes für die Fischzucht werden auf 2,85 Millionen Hektar Teiche und Tanks geschätzt. Außerdem, weitere 2,05 Millionen Hektar Wasserfläche stehen in Form von Stauseen oder Seen zur Verfügung. Es wurde geschätzt, dass fast 14250 Millionen Jungfische für die Besatzung selbst der derzeit verfügbaren 2,85 Millionen Hektar bei einer konservativen Besatzrate von 5000 Jungfischen/ha benötigt würden. Die derzeitige Produktion beträgt 15007 Millionen Jungfische. Abgesehen davon, mindestens 4100 Mio. Jungfische werden zusätzlich benötigt, um die zur Verfügung stehende Fläche von Seen und Stauseen mit einem durchschnittlichen Besatz von 2000 Jungfischen/ha zu besetzen. Dies weist darauf hin, dass es notwendig ist, die Jungfische aufzuziehen, um die verfügbaren Wasserressourcen aufzustocken.
Der Fischsamen wird aus drei Quellen gewonnen – Fluss, Brütereien und Bünde. Das Sammeln von Samen aus Flussquellen war eine uralte Praxis. Diese Methode ist anstrengend und wir erhalten die Mischung aus erwünschtem und unerwünschtem Fischsamen. Brütereien sind der beste Weg, um Fischsamen zu bekommen. Abgesehen von diesen, Die Bundzucht ist auch eine gute Methode, um den Fischsamen zu sammeln, indem ein natürlicher Lebensraum geschaffen wird.
Die verschiedenen Flusssysteme Indiens weisen Unterschiede hinsichtlich der Verbreitung und Häufigkeit ihrer Fischfauna auf. Dies liegt vor allem an ihren individuellen ökologischen Bedingungen, wie Steigung, Terrain, fließen, Tiefe, Temperatur, Substrat, usw. Die nördlichen Flüsse sind mehrjährig und unterstützen eine reiche kommerzielle Fischerei. Außer in den Deltagebieten, die Fischerei der Halbinselflüsse ist sowohl im Oberlauf als auch im Mittellauf schlecht.
1 ich n du C e D B R eed ich n g T e C h Nein l Ö g ja
Karpfen brüten in fließenden Gewässern wie Flüssen. Natürlich brüten sie nie in begrenzten Gewässern. Das aus natürlichen Ressourcen gewonnene Saatgut ist im Allgemeinen ein gemischter Bestand mit wünschenswerten und unerwünschten Sorten. Die Trennung von wünschenswertem Saatgut von Mischgut ist ein großes Problem. Aufgrund der Handhabung, die wünschenswerten Sorten können sterben. Wenn irgendein räuberischer Fischsamen gefunden wird, sie verletzen wünschenswerte Fischsamen. Ein weiteres großes Problem ist, dass Sie niemals die erforderliche Anzahl in der natürlichen Sammlung erhalten. Die Verfügbarkeit von reinem Saatgut ist sehr schwierig. Um all diese Probleme zu überwinden, ist die induzierte Züchtung eine ausgezeichnete Technik, um reines und erforderliches Fischsamen zu erhalten. Es hat mehrere Vorteile. Durch induzierte Züchtung kann reines Saatgut erwünschter Arten gewonnen werden. Angenommen Rohu-Samen ist notwendig, Nur Rohu-Samen kann in ein paar Tagen produziert werden. Mit dieser Technik kann die erforderliche Anzahl von Samen produziert werden. Angenommen, eine Fischfarm benötigt 1 crore Fischsamen, diese Zahl kann sehr einfach in kürzerer Zeit hergestellt werden. Die Probleme der Identifizierung und Trennung von Saatgut treten nicht auf. Diese Technik ist sehr einfach. Es kann gesundes Saatgut produziert werden. Fische können mehrmals im Jahr laichen. Hybridisierung ist möglich.
Bei induzierten Züchtungstechniken, Vier Hauptarten von Materialien werden verwendet, um Fischen Injektionen zu geben – Hypophysenextraktionen, HCG, Ovaprim und Ovatid.
Ind du ce D Breedin g Witz h Pi T uitar ja Eichel D Extra ein ctio n
Die Fischzucht durch Hypophysenextraktion ist ein wirksames und zuverlässiges Verfahren zur Gewinnung von reinem Saatgut von Kulturfischen und wird heute in Indien sowie in vielen anderen Ländern der Welt in relativ großem Umfang praktiziert. Dabei werden ausgewachsenen weiblichen und männlichen Fischen Extrakte der Hypophyse aus anderen ausgewachsenen Fischen injiziert.
h istori C ein l Zurück g runden:
Das heutige Konzept der Rolle der Hypophyse bei der Fortpflanzung von Wirbeltieren soll aus den Experimenten von Aschheim und Zondek im Jahr 1927 stammen, als sie herausfanden, dass Hypophysenimplantate die sexuelle Entwicklung weiblicher Mäuse beschleunigten. Drei Jahre später, 1930, Houssay aus Argentinien führte das erste derartige Experiment an einem Fisch durch. Er injizierte einen kleinen lebendgebärenden Wels, Cresterodon decammaculatus mit Hypophysenextrakten aus einem anderen Fisch, Prochilodus platensis bewirkt die Frühgeburt von sich entwickelnden Jungen. 1934, eine erfolgreiche Technik konnte von Ihring entwickelt werden, in der bestimmte brasilianische Teichfische zum Laichen gebracht wurden, indem ihnen eine Suspension frischer Hypophysen, die von anderen weniger wertvollen Fischarten gesammelt wurden, injiziert wurde. Die Brasilianer, daher, waren die ersten, die die Technik der Fischzucht durch Hypophysierung erfolgreich einsetzten. 1937, Dem russischen Wissenschaftler Gerbiskii gelang es, eine bedeutende Anzahl von Stören zu induzieren, Acipenser stellatus.
Indien ist das dritte Land der Welt, das die Technik zu einem festen Bestandteil seines Fischzuchtprogramms macht. Der erste Versuch einer Hypophysierung in Indien wurde von Hamid Khan im Jahr 1937 unternommen, als er versuchte, das Laichen bei Cirrhinus mrigala durch die Injektion der Hypophyse von Säugetieren zu induzieren. Der nächste Versuch wurde 1945 von Hussain mit bestimmten Hormonen wie 80-120 RV Prolan und Antutrin-S in weibliche Labeo rohita und Cirrhinus mrigala unternommen. 1955, Hiralal Choudhuri gelang es, durch intraperitonale Injektion von Hypophysenextrakt von Catla Catla das Laichen bei Esomus danricus zu induzieren. Auch die Zucht von Pseudotropius atherinoides gelang ihm. Ramaswamy und Sunderaraj brüteten 1955 bzw. 1956 in Heteropneustes fossilis und Clarias batrachus. Der erste Erfolg bei der induzierten Zucht von indischen Großkarpfen durch Hypophysierung wurde 1957 von Hiralal Chaudhuri und Alikunhi am CIFRI erzielt. Schnitt.
Fis h P ich Tut ein R ja Gla n D :
Die Hypophyse von Fischen ist eine kleine, weicher Körper und cremeweiße Farbe. Bei Karpfen ist er mehr oder weniger rund. Es liegt auf der ventralen Seite des Gehirns (Abb. 3.1) hinter dem Chiasma opticum in einer Aushöhlung des Bodens der Gehirnbox, bekannt als Sella turcica und von einer dünnen Membran namens Duramater umgeben. Bei wenigen Fischen ist es durch einen dünnen Stiel mit dem Gehirn verbunden, als infundibulärer Stiel bekannt. Basierend auf dem infundibulären Stiel, die Drüsen werden in zwei Typen eingeteilt, nämlich, platybasic – ohne Stiel, einen offenen Recessus infundibularis haben und leptobasisch – mit Stiel, obliterierter Recessus infundibularis. Der leptobasische Typ der Hypophyse wird bei Karpfen und der platybasische Typ bei Channidae und Nandidae gefunden. Die Größe und das Gewicht der Drüse variieren je nach Größe und Gewicht des Fisches. In Labeo rohita, das durchschnittliche Gewicht der Hypophyse beträgt 6,6 mg bei 1-2 kg Fisch, 10,3 mg in 2-3 kg Fisch, 15,2 mg in 3-4 kg Fisch und 18,6 mg in 4-5 kg Fisch.
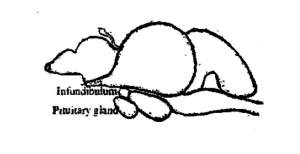
Die Hypophyse sondert die gonadotropen Hormone ab, FSH oder Follikelstimulierendes Hormon, und LH oder luteinisierendes Hormon. Beide Hormone werden das ganze Jahr über ausgeschüttet. aber der Anteil, in dem sie sezerniert werden, korreliert direkt mit dem Zyklus der Gonadenreife. Das FSH bewirkt das Wachstum und die Reifung von Eierstockfollikeln bei Frauen und Spermatogenese bei den Hoden von Männern. LH hilft bei der Umwandlung der Eierstockfollikel in Corpus lutea bei Frauen und fördert die Produktion von Testosteron bei Männern. Diese Hormone sind nicht speziesspezifisch, d.h., ein Hormon, das von einer Art gewonnen wird, ist in der Lage, die Gonaden eines anderen Fisches zu stimulieren. Jedoch, Es gibt große Unterschiede in der Wirksamkeit bei verschiedenen Arten. Experimente zur induzierten Zucht von Fischen haben die relative Wirksamkeit von Fisch-Hypophysenextrakten gegenüber den Hypophysenhormonen von Säugetieren deutlich gezeigt. Sexualhormone und verschiedene Steroide. Dies ist der Grund, warum Fischhypophyse heute in großem Umfang in der Fischzucht auf der ganzen Welt verwendet wird.
Sammeln Ö n Ö F Hypophyse ja Drüse :
Der Fisch, der die Hypophyse spendet, d. Der Fisch, aus dem die Hypophyse gewonnen wird, wird Spenderfisch genannt. Der Erfolg bei der induzierten Zucht von Fischen hängt in hohem Maße von der richtigen Auswahl der Spenderfische ab. Die Drüse sollte vorzugsweise von vollreifen trächtigen Fischen gewonnen werden, da die Drüse zum Zeitpunkt der Zucht oder kurz vor dem Laichen am stärksten ist. Die Potenz der Drüse nimmt nach dem Laichen ab. Drüsen, die von unreifen oder verbrauchten Fischen gesammelt wurden, liefern normalerweise keine zufriedenstellenden Ergebnisse. Drüsen in induzierten Zuchtfischen, die unmittelbar nach dem Laichen gesammelt wurden, haben sich ebenfalls als wirksam erwiesen und können zur Zucht anderer Fische verwendet werden. Die am besten geeignete Zeit in Indien zum Sammeln von Hypophysen von großen Karpfen ist während der Monate Mai bis Juli, da die Mehrheit der Karpfen in dieser Zeit fortgeschrittene Reifestadien erreicht. Da Karpfen, Cyprinus carpio ist ein mehrjähriger Züchter, seine ausgewachsenen Individuen können fast das ganze Jahr über zum Sammeln von Drüsen gewonnen werden. Die Drüsen werden normalerweise bevorzugt von frisch getöteten Fischen gesammelt, aber auch solche von eiskonservierten Exemplaren werden verwendet.
In verschiedenen Ländern werden verschiedene Techniken zum Sammeln von Hypophysen angewendet. In Indien, Die allgemein angewandte Technik der Drüsenentnahme besteht darin, die Kopfhaut des Fischschädels durch einen schrägen Strich eines Metzgermessers abzuhacken. Nachdem die Kopfhaut entfernt wurde, die über dem Gehirn liegende graue Substanz und Fettstoffe werden mit einem Wattebausch schonend gereinigt. Das so freigelegte Gehirn wird vorsichtig herausgehoben, indem es von den Nerven gelöst wird. Bei den meisten Cypriniden wenn das Gehirn gehoben wird, die Drüse bleibt auf dem Boden der Gehirnbox zurück. Der die Drüse bedeckende Duramater wird dann vorsichtig mit einer feinen Nadel und einer Pinzette entfernt. Die freigelegte Drüse wird dann intakt aufgenommen, ohne sie zu beschädigen, da beschädigte und gebrochene Drüsen zu einem Potenzverlust führen.
Drüsen werden auch durch das Foramen magnum gesammelt. Es ist, in der Tat, eine viel einfachere Methode zur Entfernung von Drüsen, die von den Fachleuten häufig für die Massensammlung auf überfüllten und lauten Fischmärkten praktiziert wird. Bei dieser Methode der Drüsensammlung der Fisch muss im Wesentlichen enthauptet werden. Auf Märkten, Drüsen werden aus Fischköpfen gesammelt, die bereits von Einzelhändlern geschnitten wurden. In den geschnittenen Fischköpfen, das Foramen ist von hinten deutlich zu sehen, in dem sich graue Substanz und Fettstoffe befinden. Das Gehirn liegt auf den ventralen Seiten des Foramens. Zum Herausnehmen der Drüse, die graue Substanz und die Fettstoffe werden zunächst entfernt, indem das stumpfe Ende der Pinzette in das Foramen eingeführt und die gesamte Substanz herausgezogen wird, ohne das Gehirn zu stören. Das Gehirn wird vorsichtig angehoben und nach vorne geschoben oder aus dem Loch gezogen. Die am Boden der Gehirnbox liegende Drüse wird dann mit einer feinen Pinzette aufgenommen. Ein experimenteller Arbeiter schafft es leicht, in einer Stunde etwa 50-60 Drüsen zu sammeln, indem er diese Entnahmetechnik anwendet.
P Reservierung Ö F Pituit ein R ja Drüse S :
Wenn die gesammelten Drüsen nicht für den Gebrauch bestimmt sind, sie müssen erhalten bleiben. Aufgrund ihrer Glyko- oder Mukoproteinnatur, sie unterliegen einer sofortigen enzymatischen Wirkung. Die Hypophyse kann durch drei Methoden konserviert werden – absoluter Alkohol, Aceton und Einfrieren. In Indien wird die Konservierung der Hypophyse von Fischen in absolutem Alkohol bevorzugt. Außerdem, Bisherige Versuche mit alkoholkonservierten Drüsen an indischen Großkarpfen haben positivere Ergebnisse gebracht als mit acetonkonservierten Drüsen.
Die Drüsen werden nach der Entnahme sofort zur Entfettung und Austrocknung in absoluten Alkohol gelegt. Jede Drüse wird in einem separaten Fläschchen aufbewahrt, das mit der Seriennummer gekennzeichnet ist, um die Identifizierung zu erleichtern. Nach 24 Stunden, die Drüsen werden mit absolutem Alkohol gewaschen und wieder in frischem absolutem Alkohol in dunklen Flaschen aufbewahrt und entweder bei Raumtemperatur oder im Kühlschrank aufbewahrt. Gelegentliches Wechseln des Alkohols hilft, die Drüsen über längere Zeit in gutem Zustand zu halten. Um zu verhindern, dass Feuchtigkeit in die Ampullen gelangt, sie können in einem Exsikkator aufbewahrt werden, der etwas wasserfreies Calciumchlorid enthält. Es ist vorzuziehen, die Drüsen im Kühlschrank aufzubewahren. Sie können im Kühlschrank bis zu 2-3 Jahre und bei Raumtemperatur bis zu einem Jahr gelagert werden.
Aceton ist auch ein gutes Konservierungsmittel. Bei dieser Methode, kurz nach Abholung, die Drüsen werden in frischem Aceton oder in mit Trockeneis gekühltem Aceton in einem Kühlschrank bei 100 °C 36-48 Stunden lang aufbewahrt. Während dieser Zeit, das Aceton wird 2-3 Mal in Intervallen von etwa 8-12 Stunden gewechselt, um eine ordnungsgemäße Entfettung und Austrocknung zu gewährleisten. Die Drüsen werden dann aus Aceton herausgenommen, auf ein Filterpapier legen und eine Stunde bei Raumtemperatur trocknen lassen. Anschließend werden sie im Kühlschrank bei 100 °C gelagert. vorzugsweise in einem Exsikkator, der mit Calciumchlorid oder anderen Trocknungsmitteln gefüllt ist. Die Konservierung von Drüsen in Aceton wird weitgehend in der UdSSR und den USA praktiziert.
P Wiedergutmachung Ö F Pituita R ja Gl ein n D E xtract :
Konservierte Drüsen werden dann gewogen. Dies ist für eine genaue Bestimmung der Dosis, die entsprechend dem Gewicht der Züchter zu verabreichen ist, unerlässlich. Das Gewicht der Drüse kann einzeln oder in einer Gruppe gemessen werden. Um ein genaueres Gewicht zu erhalten, eine Drüse sollte genau zwei Minuten nach der Entfernung aus dem Alkohol gewogen werden.
Der Hypophysenextrakt sollte kurz vor der Injektion zubereitet werden. Die zur Injektion benötigte Drüsenmenge wird zunächst aus dem Gewicht des zu injizierenden Züchters berechnet. Anschließend werden die Drüsen ausgewählt und die benötigte Menge an Drüsen aus den Ampullen entnommen. Der Alkohol wird verdunstet, wenn die Drüsen alkoholkonserviert sind. Acetongetrocknete Drüsen werden direkt aus den Ampullen zur Mazeration entnommen.
Die Drüsen werden dann in einem Gewebehomogenisator mazeriert, indem eine abgemessene Menge von destilliertem Wasser oder Kochsalzlösung oder einer physiologischen Lösung, die mit dem Blut des Empfängerfischs isotonisch ist, zugegeben wird. Die erfolgreichsten Ergebnisse der induzierten Zucht bei den indischen Großkarpfen wurden bisher mit destilliertem Wasser und 0,3% Kochsalzlösung erzielt. Die Konzentration des Extrakts wird normalerweise im Bereich von 1-4 mg Drüse pro 0,1 ml des Mediums gehalten, d.h. in einer Menge von 20-30 g. der Drüse in 1,0 ml des Mediums. Nach der Homogenisierung, die Suspension wird in ein Zentrifugenröhrchen überführt. Während der Übertragung, Das Homogenat sollte gut geschüttelt werden, damit abgesetzte Drüsenpartikel, die mit der Lösung vermischt werden, in das Zentrifugenröhrchen gelangen. Der Extrakt im Röhrchen wird zentrifugiert und die überstehende Flüssigkeit wird zur Injektion in eine Injektionsspritze aufgezogen.
Der Hypophysenextrakt kann auch in großen Mengen hergestellt und in Glyzerin (1 Teil Extrakt :2 Teile Glyzerin) vor der Zuchtsaison der Fische konserviert werden, so dass die Mühe vermieden wird, den Extrakt jedes Mal vor der Injektion zuzubereiten. Der Brühextrakt sollte immer im Kühlschrank oder auf Eis gelagert werden.
T e C h niq du e Ö F B ree D ing :
Der induzierte Brutbetrieb der Großkarpfen wird mit dem Einsetzen des regelmäßigen Monsuns wieder aufgenommen, die Fische werden vollreif und die Wassertemperatur sinkt. Frauen mit einer Runde, Für die Zucht werden ein weicher und praller Bauch mit geschwollenem rötlichem Bauch und Männchen mit frei austretender Milz ausgewählt. Ein männlicher Züchter kann auch leicht durch Rauheit auf der Rückenfläche seiner Brustflossen unterschieden werden.
1 . Tun S ag e Ö F pitui T ar ja extra ein C T :
Der wichtigste Aspekt der induzierten Zucht von Fischen ist die Beurteilung der richtigen Dosierung von Hypophysenextrakt. Die Potenz der Drüse variiert je nach Größe und Stadien der sexuellen Entwicklung des Spenders, sowie die Art der Spenderfische, Zeitpunkt der Entnahme der Drüsen und ihrer richtigen Erhaltung. Die Dosis der Hypophyse wird im Verhältnis zum Gewicht der zu injizierenden Züchter berechnet. Es wurde auch festgestellt, dass identische Dosen bei Züchtern mit ähnlichem Gewicht aufgrund unterschiedlicher Reife der Gonaden zu widersprüchlichen Ergebnissen führen können. Selbst hohe Hormondosen können nicht wirksam sein, wenn sich die Keimdrüsen im Resorptionsstadium befinden. Durch sorgfältige Auswahl der Züchter und Verabreichung eines bekannten Gewichts an Hypophysenextrakt pro kg Körpergewicht der Züchter, erfolgreiche Zucht erreicht werden kann.
Versuche zur Standardisierung von Dosen zeigen, dass die Verabreichung einer vorläufigen niedrigen Dosis bei der weiblichen Züchterin gefolgt von einer höheren wirksamen Dosis nach 6 Stunden erfolgreicher ist als eine einzelne Knockout-Dosis. Eine einzelne hohe Dosis hat sich als nützlich erwiesen, wenn die Züchter in idealer Verfassung sind und das Wetter günstig ist. Rohu spricht gut auf zwei Injektionen an, während Catla und Mrigal sowohl auf eine als auch auf zwei Injektionen ansprechen.
Eine Anfangsdosis in Höhe von 2-3 mg. Hypophyse pro kg Körpergewicht der Fische wird nur der weiblichen Züchterin verabreicht. Männliche Züchter benötigen keine Anfangsdosis, wenn sie bei leichtem Druck auf ihren Bauch Milz austreten. Zwei Männchen gegen jedes Weibchen bilden einen Zuchtsatz. Um ein gut passendes Set zu machen, Das Gewicht der Männchen zusammen sollte gleich oder höher sein als das des Weibchens. Falls der Zustand eines der beiden Männchen nicht im frei nässenden Stadium gefunden wird, Eine anfängliche Injektion kann dem Mann in einer Menge von 2-3 mg/kg Körpergewicht verabreicht werden. Nach 6 Stunden, dem Weibchen wird eine zweite Dosis von 5-8 mg/kg Körpergewicht verabreicht, während beide männlichen Tiere die erste oder zweite Dosis von 2-3 mg/kg Körpergewicht erhalten. Je nach Reifezustand der Züchter und den vorherrschenden Umweltfaktoren können geringfügige Dosisänderungen vorgenommen werden. In Ermangelung eines chemischen Gleichgewichts 1-3 Hypophysen sind für ein Fischpaar wirksam.
2 . m e NS D Ö F Injektion :
Intrakranielle Injektionen werden in der UdSSR und intraperitoneal in den USA und Japan bevorzugt. Die intramuskuläre Injektion ist die gängigste Praxis in Indien. Die intramuskuläre Injektion ist im Vergleich zu den anderen Methoden weniger riskant. Intraperitoniale Injektionen werden normalerweise durch die weichen Körperregionen verabreicht, im Allgemeinen an der Basis der Bauchflosse oder manchmal an der Basis der Brustflosse. Es besteht jedoch ein gewisses Risiko, die inneren Organe zu schädigen, insbesondere die ausgedehnten Gonaden bei der Verabreichung einer intraperitonialen Injektion bei voll ausgewachsenen Fischen.
Injektionen werden normalerweise am Schwanzstiel oder in den Schulterregionen nahe der Basis der Rückenflosse verabreicht. Während Sie den Karpfen Injektionen geben, Die Nadel wird unter einer Skala eingeführt, die sie zunächst parallel zum Körper des Fisches hält und dann schräg in den Muskel einsticht. Es gibt keine feste Regel bezüglich des Injektionszeitpunkts. Injektionen können zu jeder Tages- und Nachtzeit verabreicht werden. Da aber niedrige Temperaturen hilfreich sind und die Nacht vergleichsweise ruhiger bleibt, die Injektionen werden in der Regel in den späten Nachmittags- oder Abendstunden mit zeitlichem Abstand verabreicht
Samen Produktion T Technologien 33
so eingestellt, dass der Fisch die Stille der Nacht zum ungestörten Laichen nutzen kann.
Die zu diesem Zweck am besten geeignete Injektionsspritze ist eine 2 cc-Spritze mit einer Teilung von 0,1 cc. Die Größe der Nadel für die Spritze hängt von der Größe der zu injizierenden Züchter ab. Nr. 22 Nadel wird bequem für 1-3 kg Karpfen verwendet, Nr. 19 für größere Karpfen und Nr. 24 für kleinere Karpfen.
Die Verwendung von Anästhetika während der Injektion würde das Überleben von Brutfischen signifikant erhöhen. Häufig verwendete Anästhetika sind MS 222 und Quinaldin. MS 222 kann dem Wasser in Dosen von 50-100 mg/Liter zugesetzt werden. Eine in 0,04 M dieser Lösung getränkte Watterolle kann in das Maul des Fisches eingeführt werden. Chinaldin wird in einer Menge von 50-100 mg/Liter verwendet.
3 . B reedin g h ap ein ein D Spa w ning :
Nach der Injektion, Die Züchter werden sofort in die Zucht-Hapa entlassen. Ein Zucht-Hapa besteht in der Regel aus feinem Tuch in der Größe 3,5 x 1,5 x 1,0 m für größere Züchter und 2,5 x 1,2 x 1,0 m für Züchter unter 3 kg. Alle Seiten der Zucht-Hapa sind genäht und geschlossen, mit Ausnahme eines Teils oben, um die Züchter hineinzubringen. Allgemein, ein Satz Züchter wird in jeder Zucht-Hapa freigelassen, aber manchmal, um Hypophysenmaterial zu sparen, Gemeinschaftszucht wird auch versucht, indem die Zahl der männlichen Züchter reduziert wird. Nach der Freilassung der Fische die öffnung der hapa ist sicher verschlossen, damit züchter nicht herausspringen und entkommen können. Statt Hapas, auch zementzisternen oder plastikbecken so groß wie hapas können zur zucht verwendet werden.
Das Laichen erfolgt normalerweise innerhalb von 3-6 Stunden nach der zweiten Injektion. Kurz nach der Befruchtung die Eier schwellen durch Wasseraufnahme stark an. Befruchtete Eier großer Karpfen erscheinen wie glänzende Glasperlen von kristallklarer Transparenz, während die unbefruchteten Eier undurchsichtig und weißlich aussehen. Die Größe von Eiern derselben Art verschiedener Züchter variiert erheblich. Voll geschwollene Eier der großen indischen Karpfen haben einen Durchmesser von 2,5 mm, die größte ist die von Catla und die kleinste von Rohu. Die Karpfeneier sind nicht schwimmend und nicht klebend. Das Eigelb besitzt keine Ölkügelchen. Die großen indischen Karpfen haben eine große Eiablagekapazität. Ihre Fruchtbarkeit, im Durchschnitt, ist 3,1 lakh in rohu, 1-3 lakh in catla und 1,5 lakh in mrigal.
Die sich entwickelnden Eier werden nach dem Laichen für einen Zeitraum von mindestens 4-5 Stunden ungestört in der Brut-Hapa aufbewahrt, damit die Eier richtig wasserhärten können. Danach, die eier werden mit einem becher aus der hapa gesammelt und mit etwas wasser in einen eimer gefüllt. Die Züchter werden dann herausgenommen und gewogen, um den Unterschied vor und nach dem Laichen herauszufinden. Dies gibt eine Vorstellung von der Menge der gelegten Eier. Aus dem bekannten Volumen und der Anzahl der Eier des Probenbechers lässt sich das Gesamtvolumen und die Anzahl der Eier leicht berechnen. Auch der Anteil der befruchteten Eier wird entsprechend durch Stichproben vor und nach dem Laichen ermittelt. Dies gibt eine Vorstellung von der Menge der gelegten Eier. Aus dem bekannten Volumen und der Anzahl der Eier des Probenbechers lässt sich das Gesamtvolumen und die Anzahl der Eier leicht berechnen. Auch der Anteil der befruchteten Eier wird entsprechend stichprobenartig ermittelt.
4 . S tri P Stift g :
Chinesische Karpfen laichen jedoch nicht auf natürliche Weise und wenn sie laichen, der Düngungsanteil ist im Allgemeinen sehr gering. Es folgt daher ein Stripping (Abb. 3.1) oder eine künstliche Befruchtung. Das Weibchen wird mit nach oben geneigtem Kopf und nach unten gerichtetem Schwanz und Bauch zum Gefäß gehalten, und die Eier werden in einem Email- oder Plastiktrog gesammelt, indem man den Körper des Weibchens drückt. Der männliche Fisch wird dann in ähnlicher Weise gehalten und die Milch wird in denselben Trog gepresst. Die Gameten werden dann so schnell wie möglich mit einer Federkiel gemischt, um eine Befruchtung zu ermöglichen. Die befruchteten Eier werden dann einige Male mit sauberem Wasser gewaschen, um überschüssige Milch zu entfernen, und etwa 30 Minuten ungestört in Süßwasser bleiben gelassen. Die Eier sind dann bereit für die Freisetzung in die Bruttanks.

T e chn ich qu e Ö F h ein tch ich n g T h e e ggs :
Die Eier, die von Zucht-Hapas gesammelt werden, werden in die Brut-Hapas übertragen. Eine schlüpfende Hapa besteht aus zwei separaten Hapas, das äußere Hapa und das innere Hapa. Die innere Hapa ist kleiner und wird in die äußere Hapa eingepasst. Die äußere Hapa besteht aus einem dünnen Tuch in der Standardgröße von 2 x 1 x 1 m, während die innere Hapa aus einem rundmaschigen Moskitonetzgewebe in den Maßen 1,75 x 0,75 x 0,5 m besteht. Alle Ecken der äußeren und inneren Hapas sind mit Schlaufen und Seilen versehen, um die Installation zu erleichtern. Ungefähr 75, 000 zu 1, 00, 000 Eier werden gleichmäßig in jedem inneren Hapa verteilt. Die Eier schlüpfen in 14-20 Stunden bei einem Temperaturbereich von 24-310 C. Die Inkubationszeit, in der Tat, ist umgekehrt proportional zur Temperatur. Nach dem Schlüpfen, die Jungtiere entkommen durch die Maschen des inneren Hapa in das äußere Hapa. Die innere Hapa enthält die Eierschalen und die toten Eier, die nach dem Schlüpfen entfernt werden. Die Schlüpflinge bleiben bis zum dritten Tag nach dem Schlüpfen ungestört in der äußeren Hapa. Während dieser Zeit, sie ernähren sich von der Nahrung, die sie in ihrem Dottersack gespeichert haben. Am dritten Tag bildet sich das Maul und die Jungtiere beginnen mit der richtungsweisenden Bewegung und Nahrungsaufnahme. In diesem Stadium werden sie sorgfältig von der äußeren Brut-Hapa gesammelt und in vorbereitete Baumschulen eingelagert.
Es wurde festgestellt, dass indische Großkarpfen dazu gebracht werden konnten, zweimal in derselben Saison im Abstand von zwei Monaten zu laichen. Die Züchter werden nach dem ersten Laichen mit Erdnussölkuchen und Reiskleie im Verhältnis 1:1 bei 2,5 Prozent des Körpergewichts gefüttert. Bei günstigen klimatischen Bedingungen sie reifen und sind bereit zum Laichen.
In D uce D Br e edin g w ich T h H. C. g .
Heutzutage ist die Hypophysenextraktion eine gut etablierte Technik für die induzierte Züchtung auf der ganzen Welt. Sein großflächiger Einsatz wirft die folgenden Probleme in Bezug auf die Verfügbarkeit und Qualität der Hypophyse (P.G.) auf. Unzureichende Versorgung mit P.G., Hohe Kosten, Variabilität der Gonadotropin-Potenz der Hypophyse und Betrug durch skrupellose P.G. Lieferanten. Um diese Probleme zu überwinden, Humanes Choriongonadotropin (H.C.G) wurde als Alternative für die Hypophyse gefunden. H.C.G. wurde Anfang 1927 von Aschheim und Zondek entdeckt. Sie extrahierten qualitativ hochwertiges Hormon mit luteinisierender gonadotroper Aktivität aus dem Urin schwangerer Frauen. Russische Arbeiter verwendeten erstmals 1964 Choriongonadotropin unter dem Handelsnamen Choriogohin und erzielten gute Ergebnisse bei Schmerle. Bratanor (1963) und Gerbilski (1965) verwendeten H.C.G. bei Karpfen und Forellen und erzielten große Erfolge. Tang (1968) stellte fest, dass bei der Behandlung chinesischer Karpfen mit Fischhypophyse in Kombination mit C.G. Wirksamkeit bei der induzierten Züchtung erhöht. Eine Durchsicht der Literatur zeigt, dass H.C.G. ist entweder allein oder in Kombination mit P.G. Extrakt bei der Induktion verschiedener Fische auf der ganzen Welt.
H.C.G. ein Glykoprotein oder Sialoprotein ist, wegen der Kohlenhydratmoleküle, die an die Proteinmoleküle gebunden sind. Seine Hauptfunktion besteht darin, die Produktion von Östrogen und Progesteron durch den Gelbkörper aufrechtzuerhalten. Es wird von der Plazenta produziert und in den frühen Stadien der Schwangerschaft (2-4 Monate) über den Urin ausgeschieden. H.C.G besteht aus 2 Untereinheiten a und b und hat eine Molekülgröße von 45, 000-50, 000 Dalton. Es enthält 17 Aminosäuren, davon Alanin, Prolin, Serin, Cystin und Histidin sind wichtig. Aufgrund der großen Anzahl an Aminosäuren, H.C.G. hat einen hohen Proteingehalt. Das Molekulargewicht wurde mit 59 angegeben, 000 durch Gelfiltration und 47, 000 durch Sedimentationsgleichgewicht.
In den frühen Stadien der Schwangerschaft H.C.G. ist reich im Urin von Schwangeren. Zur Extraktion von H.C.G. Aschheim und Zondek (1927) verwendeten Ethanol zur Fällung. Katzman und Caina verwendeten unterschiedliche Absorptionsmittel. Kommerzielle rohe H.C.G-Extraktion wird mit Gelfiltration durchgeführt.
Follikelstimulierendes Hormon (FSH) und luteinisierendes Hormon (LH) der Hypophyse spielen eine wichtige Rolle bei der normalen Fortpflanzung von Fischen, d.h. bei der Förderung der Entwicklung von Gonaden, Wachstum, Reife und Laichen. H.C.G ist in Charakter und Funktion mehr oder weniger ähnlich zu F.S.H und L.H. Da die Hypophyse zur induzierten Fischzucht verwendet wird, H.C.G kann auch zur frühen Reifung von Gonaden verwendet werden. Die Überlegenheit von H.C.G gegenüber P.G kann aus den folgenden Gründen gemessen werden. Fische werden mit H.C.G. schneller reif, der Laich der Brutzeit kann mit H.C.G. erhöht werden., H.C.G. sorgt für ein besseres Überleben des Laichs, es verringert den zeitlichen Abstand zwischen Vorbereitungs- und Enddosierung, H.C.G ist wirtschaftlicher und hat eine lange Haltbarkeit, H.C.G ist leicht von einer Standardquelle erhältlich, Daher ist es zuverlässiger, regelmäßige H.C.G-Injektionen während des ganzen Jahres sorgen für eine bessere Gesundheit und Gewichtszunahme sowie die Entwicklung der Gonaden. Die Wirksamkeit von H.C.G ist bekannt (30 I.E./mg), erhältlich in ordentlichen Packungen mit bekannten Gewichten, keine Konservierung beteiligt ist, kann nicht falsch sein, H.C.G-behandelte Fische können in derselben Saison mehr als einmal für die induzierte Zucht verwendet werden, Die Sterblichkeitsrate der Jungtiere ist vernachlässigbar, Der Konsum des Medikaments ist während der induzierten Züchtung geringer, H.C.G kann als Wachstumshormon verwendet werden und die Aufnahme von Eiern am Ende der Brutsaison ist durch die Gabe von H.C.G vergleichsweise geringer.
Das rohe H.C.G liegt in Pulverform vor und hat eine grauweiße oder hellgelbe Farbe. Es löst sich leicht in Wasser auf. Die berechnete Menge an rohem H.C.G wird in einen Gewebehomogenisator gegeben und 5–10 Minuten mit abgemessenem destilliertem Wasser gerührt. Es wird 3-5 Minuten zentrifugiert. Die klare hellgelbliche überstehende Flüssigkeit mit den H.C.G-Hormonen wird entnommen und sofort injiziert. Jede Verzögerung der Anwendung führt zum Verlust der Potenz.
Bei Silberkarpfen (Hypophthalmichthyes molitrix) Die Verwendung von H.C.G hat sich als recht erfolgreich erwiesen. Die Dosierung beträgt 4-6 mg/kg. Körpergewicht des Mannes, und 6-8 mg/kg Körpergewicht der ersten Dosis und nach etwa 6-7 Stunden, 10-12 mg/kg Körpergewicht der zweiten Dosis für Frauen, die gute Ergebnisse lieferte. Die alleinige Verwendung von H.C.G in der Zucht von indischen Großkarpfen hat bisher keine erfolgreichen Ergebnisse gebracht. Eine Kombination von 60-80% H.C.G und 40-20% P.G für indische Großkarpfen und Graskarpfen (Ctenopharyngodon idella) ist erfolgreich. Fische, die allein mit H.C.G zur Fortpflanzung verleitet werden, sind Meeräschen, Cyprinus carpio, Lctalurus punctatus, Oreochromis nilotica, Aristichthys nobilis, Misgurnus fossilis, Esox lucius und Epinephelus tauvina.
Neuere Arbeiten zeigen, dass die Kombination von H.C.G. und P.G. ist empfehlenswerter als H.C.G oder P.G allein. Es müssen weitere Arbeiten unternommen werden, um die Dosierung von H.C.G für die induzierte Zucht von großen Karpfen und chinesischen Karpfen zu standardisieren.
In D uce D Bree D in g w es h Ö Dampf ich m
Aufgrund des Problems der unterschiedlichen Potenz der Hypophyse, Alternativen wurden ausprobiert. In verschiedenen Ländern wurden Versuche unternommen, die Analoga der luteinisierenden Hormone – Releasing-Hormone (LH-RH) für die induzierte Zucht von Fischen mit unterschiedlichem Erfolg zu verwenden. Jedoch, der mit LH-RH erzielte Erfolg war nicht immer konstant, abgesehen von seinem höheren Dosisbedarf zur Induktion des Laichens. Diese epochale Untersuchung ebnete den Weg für die Entwicklung einer einfachen und effektiven Technologie zur induzierten Zucht der meisten kultivierbaren Fische. In einem gemeinsamen Kooperationsprojekt gefördert vom Internationalen Entwicklungsforschungszentrum, Kanada an Dr. Lin aus China und Dr. Peter aus Kanada, eine Reihe von Untersuchungen wurde durchgeführt, um eine zuverlässige Technologie für die Zucht von Fischen zu entwickeln. Ihre Untersuchungen führten zur Entwicklung einer neuen Technik, die als „LNPE“-Methode bezeichnet wird. wobei ein Analog von LH-RH mit einem Dopamin-Antagonisten kombiniert wird. Nach dem Prinzip, M/s Syndel Laboratories Limited, Kanada hat ein neues Medikament namens Ovaprim hergestellt.
Ovaprim ist ein gebrauchsfertiges Produkt und die Lösung ist bei Umgebungstemperatur stabil. Es enthält ein Analogon von 20 µg Lachs-Gonadotropin-Releasing-Hormon (sGnPHa) und einen Dopamin-Antagonisten, Domperidon bei 10 mg/ml. Die Wirksamkeit von Ovaprim ist einheitlich und enthält sGnRHa, das bekanntermaßen 17-mal stärker ist als LH-RH (Peter, 1987). Der Dopamin-Antagonist, Es wird auch berichtet, dass Domperidon, das in Ovaprim verwendet wird, besser ist als andere häufig verwendete Antogonisten, Pimozid. Ovaprim ist ein gebrauchsfertiges Produkt, das keine gekühlte Lagerung erfordert. scheint das bequemste und wirksamste Mittel für den Eisprung zu sein.
Dieses Medikament wird weiblichen und männlichen Brutfischen gleichzeitig in einer Einzeldosis verabreicht. im Gegensatz zu Hypophysenextrakt, der in zwei geteilten Dosen verabreicht wird. Dies reduziert nicht nur die Handhabung von Brutfischen, sondern hilft auch, viel Zeit und Arbeit zu sparen, was die Kosten der Saatgutproduktion zusätzlich erhöht. Es wurde festgestellt, dass die Laichreaktion bei den behandelten Arten der bei den mit Hypophysenextrakt injizierten Arten überlegen ist.
Die Effizienz von ovaprim für die induzierte Zucht von Karpfen hat sehr ermutigende Ergebnisse bei Catla, roh, mrigal, Silberkarpfen, Graskarpfen, großer Kopf, usw. Es wurde festgestellt, dass die für verschiedene Karpfenarten erforderliche wirksame Dosis beträchtlich variiert. The common dose for all carps is 0.10-0.20 ml ovaprim/kg body weight of males and 0.25-0.80 ml ovaprim/kg body weight of females. Female catla is found to respond positively for a dose range of between 0.4-0.5 ml/kg, while rohu and mrigal respond to lower doses of 0.35 ml/kg and 0.25 ml/kg respectively. Among exotic carps, silver carp and grass carp are bred at doses ranging between 0.40-0.60 ml/kg. Big head carp bred successfully at 0.50 ml/ kg. For males of Indian carps, 0.10-0.15 ml/kg and for exotic male carps 0.15-0.20 ml/kg of dosages are found to be optimum. The method of injection is the same as pituitary.
In many countries including our country, ovaprim is used on a large scale for induced breeding of all cultivable fishes successfully. In Indien, initial trials were conducted during 1988 in Karnataka, Andhra Pradesh and Tamil Nadu.
Ovaprim has unique advantages over pituitary hormone – ready to use liquid form in 10 ml vial, consistent potency and reliable results, long shelf life, and can be stored at room temperature, formulated to prevent over dosing, male and female can be injected only once simultaneously, reduces handling and post breeding mortality, repeated spawning possible later in the season and high percentage of eggs, fertilization and hatching.
In D uce D br e edin g w ich T h Ö vati D e
Ovatide is an indigenous, cost-effective and new hormonal formulation for induced breeding of fishes. The new formulation is having the base of a synthetic peptide which is structurally related to the naturally occuring hormone, goanadotropin releasing hormone (GnRH). GnRH is not a steroidal hormone and belongs to the class of organic substances called peptides. It is presented as a low viscosity injectable solution which is not only highly active but also cost-effective compared to other commercially available spawning agents. It is also effective in breeding major carps and catfishes. The doses for females are 0.20-0.40 ml/kg for rohu and mrigal, 0.40-0.50 ml/kg for catla, silver carp and grass carp and 0.20-0.30 ml/kg for calbasu. The dosages for males are 0.10-0.20 ml/kg for rohu, mrigal and calbasu, 0.20-0.30 ml/ kg for catla and 0.20-0.25 ml/kg for silver carp and grass carp.
The advantages of ovatide are:It is cost-effective hormonal preparation, it gives high fertilisation and hatching percentage (85-95%), it is increases egg production through complete spawning, it produces healthy seed, it is easy to inject due to its low viscosity, it does not cause adverse effects on brood fish after injection, it can be administered in a single dose to brooders, it can be stored at room temperature, it is quite effective even under climatic adversities and ovatide is available in the market as 10 ml vial, which costs Rs. 300. It is cheaper than ovaprim. The selection of brooders and injecting methods are similar to pituitary extract.
Ind du ce D B reedin g Witz h Ovop e l
Ovopel, developed by the University of Godollo in Hungary, is a preparation containing mammalian GnRH and the water-soluble dopamine receptor antagonist, metoclopramide. The concentration of D-Ala6, Pro9NEt-mGnRH and metoclopramide are in the form of 18-20 micro gm/pellets and 8-10mg/pellets respectively. The hormone is thus available in pellet form. Each pellet contains superactive gonadoptropin releasing hypothalamic hormone analogue with an equal effect which a 3 mg normal acetone-dried dehydrated carp hypophysis gland has. Induced propagation of fish had been shown to be more effective if the hormone was administered in two doses, prime dose and resolving dose, as reported by Szabo, T., 1996. For cyprinids successful results were reported when 2-2.5 pellets/kg were administered to female brood fish. Jedoch, preliminary trial with single injection of Ovopel gave encouraging result on a few species of Indian major carps and Clarias batrachus.
The required amount of ovopel was calculated on the basis of weight and condition of brood fish. The pellets were pulverized in a mortar and dissolved in distilled water. The trails were conducted in July-August of 1999.
The new inducing agent. ovopel is easy to store, simple to use and less expensive, as reported by Szabo. T, 1996. However, in Indien, detailed studies to establish its efficacy and economic viability are required to be undertaken. The hormone has been successfully tested for ovulation in several species of cyprinids, the Common carp, the Silver carp and the tench (Horvath et al, 1997) in Europe. Ovulation was also reported in African Cat fish (Brzuska, E. 1998). In Indien, Ovopel was used with success in induced breeding of major carps in UP, Haryana and Punjab. In Assam the trials conducted recently on Labeo rohita (Rohu), Cirrihinus mrigala (Mrigal), Labeo gonius (Gonius) and Clarias batrachus (Magur) gave encouraging results. This indicates the possibility of using this new hormone preparation for commercial production of fish seeds if made available to farmers at a competitive price.
Ö T er R Su B sta n ce S uns e D F Ö R ich n du e D B R ee D in g
Other substances like LH-RH analogues, Steroide, and clomiphene are used for induced breeding of fishes.
LH-R h analo g ue :
Various analogues of Luteinizing hormone -releasing hormone (LH-RH) have been used for induced breeding of fishes. Investigations have revealed that the potential action of releasing hormone when dopamine antagonist is simultaneously used with the analogues is (10-100 µg/kg) used successfully in China. An analogue of teleost GNRH is found to be more potent than LH-RH. GNRH (Gonadotropin releasing hormone) stimulates GTH(Gonadotropin hormone) in teleosts (dosage 25-100 µg/kg).
S T e roids:
Selected steroid hormones are used to induce fish. The effects of steroid hormones on ovulation are seen primarily as germinal vesicle breakdown (GVBD). Ovulated oocytes require at least 4 hours to become fertilisable in mullets, whereas in most of the fishes oocytes are fertilisable immediately. The action of pituitary gonadotropins on oocyte maturation is known to be mediated through steroid hormones. Deoxycorticosterone acetate (DOCA) and cortisone effectively stimulate (dosage 50 mg/kg of fish) ovulation in Heteropneustes fossilis (Goswamy and Sunderraj, 1971). 17á-hydroxy-20B dihydroprogesterone (17á-20BDP) is useful to induce gold fish, trout and pikes (Jalabert, 1973). Other steroid hormones commonly used for spawning teleosts are cortisone acetate, deoxycortisol, deoxycorticosterone, hydroxycortisone, progesterone, 11 deoxycorticosterone and 20B progesteron. The advantages of steroids are:most compounds are available as pure preparations in synthetic forms, the quality of steroid preparations is uniform and steroid hormones are much cheaper than gonadotropin preparations.
Cl Ö miph e ne :
It is an analogue of the synthetic non-steroidal estrogen chlorotrianisene. It is known to have antiestrogenic effects in teleosts. It triggers the release of gonadotropins. The injections of clomiphene (10 µg/g) induced ovulation within 4 days in gold fish, whereas with same dosage, common carp spawned successfully after 40-64 hours.
E S T ich m ein T ich Ö n Ö F E g g S :
The eggs are collected from the hapa by means of cup or tray or beaker and transferred to the buckets. The breeders are also removed from the hapa and their weights areoted. The difference in weights reveals approximately the number of eggs laid. The eggs are kept in a rectangular piece of close meshed mosquito net and allow the water to drain off. The eggs are measured in a beaker, mug or cup of known volume and transferred to hatcheries. Thus estimation of total quantity is made from total volume of the eggs measured. Percentage of fertilization can be arrived at by counting the number of fertilized eggs from egg samples of 1 ml measure.
B R ead ich n g Ö F C Ö m mo n C ar P :
Common carp (Cyprinus carpio) generally breeds in confined water. Spawning takes place in shallow marginal, weed infected areas from January to March and from July to August. Common Carp is also observed to breed round the year. Controlled breeding of common carp is conducted to achieve better spawning and hatching. A set of selected brooders one female and two males are put together in breeding hapa. In order to ensure successful spawning sometimes the female fish is injected with pituitary gland extract at a low dose 2 to 3 mg per kg. Body weight. Freshly washed aquatic weeds (Hydrilla, Najas, Eichhornia etc) are uniformly distributed inside the hapa. These aquatic weeds act as egg collections. The quantity of weed used is roughly double the weight of the female introduced. Each weed attached with 40, 000 zu 1, 00, 000 eggs are distributed into a single hatching hapa. After 4 or 5 days the weeds are taken out carefully.